3:局所療法で治癒をめざす
PAGE CONTENTS
■ 前立腺がん《治療法早見表》
■ 監視療法
■ フォーカルセラピー
● 小線源療法(恥骨後式、会陰式)
● HIFE(高密度焦点超音波療法)
● 凍結療法(クライオセラピー)
■ 手術療法
● 開腹手術(恥骨後式、会陰式)
● 腹腔鏡手術
● 小切開(ミニマム創)手術
● ロボット支援手術
■ 放射線療法
● 外部照射
・IMRT(強度変調放射線治療)
・IGRT(画像誘導放射線治療)
・オリゴメタ(少数転移)
・粒子線治療(重粒子線、陽子線)
● 組織内照射(小線源療法:ブラキセラピー)
・低線量率小線源療法(LDR)
・高線量率小線源療法(HDR)
・トリモダリティ(小線源+外照射+ホルモン療法)
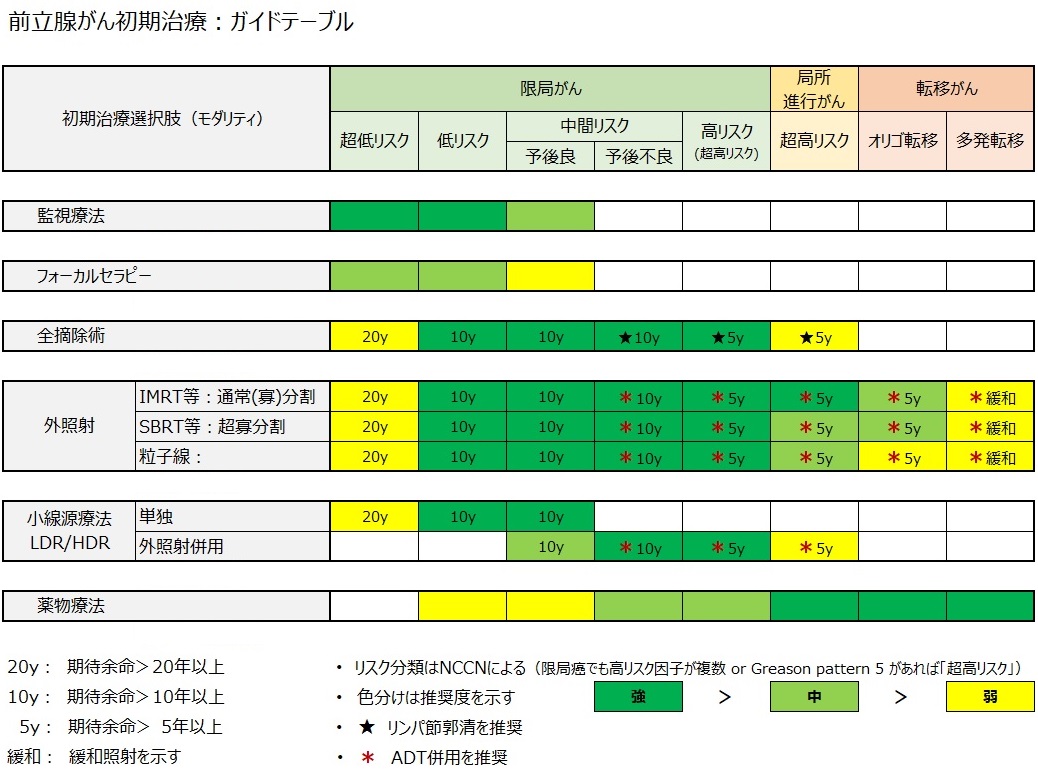
前立腺がん《治療法早見表》
「リスク分類」(前章)がわかれば、下の「前立腺がん治療法早見表」でそれに適した治療法が見つかります・・・たかが早見表、されど早見表!
「前立腺がん診療ガイドライン」に倣って、多少格好をつけるなら、「初期治療のリスク別アルゴニズム」と言っても良いでしょう。
得意とする守備範囲が違うと、専門医でも見解にはかなり個人差があり、こうした表はなかなかまとまりにくいのも事実ですが、最小公倍数でまとめてしまうと、患者としては簡単すぎて、さっぱり役に立たない代物となってしまいます。
この章では、各分野をできるだけ公平に見ながら、患者目線で作成してみたので、実施例の多寡はほとんど選択条件に含んでおりません。
同じ治療法でも、医療施設によってかなり技術レベルに開きがあるのも事実なので、この「治療法早見表」においては、いずれの治療法でも一定以上の技術レベルに達している医療施設であることを前提としています。
どの治療法を選ぶかはそれぞれの個別事情に照らし合わせてあなた自身で決めてください。
主治医の説明を良く聞かれることはもちろん大切ですが、主治医によって意見が異なることは珍しくありません。
患者として気をつけなければならないのは、主治医の説明がはたして全治療法に対し
客観的かつ公平かどうかということです。
所属病院の泌尿器科という枠内での発想であれば、「公平」には疑問がつくケースも珍しくありません。
・自分の手掛け易い治療法、もしくは自分の病院で可能な治療法を勧めやすい。
・専門外の療法もしくは他の診療科、他の病院でしかできない治療法は勧めない。
こうしたことは珍しくないので、十分注意されたほうが良いと思います。
一方的に手術を勧め、入院日まで急かすような場合は、とりあえず「考えさせてください」と言って逃げたほうが賢明でしょう。
考える時間がないほど症状が急激に進展するようなケースは前立腺がんではまずありませんので。
下の「早見表」は リスク分類に応じた治療法 を示していますが、色を変えることにより推奨度の違いを3段階で表しています(凡例注記を参照)。
前立腺がん治療法早見表
・GS3+4(GG2)
・生検陽性5割未満
*期待余命
・平均余命(下表)に健康状態を加味(±50%)して判定する。
・期待余命=平均余命 ±(平均余命x50%)
・平均余命20年とは概ね63歳、平均余命10年とは概ね77歳
監視療法
低リスクがんの場合、10年生存率は治療を行っても行わなくても、ほとんど変わらないと言われています。
つまり、特別な処置をしなくても健康なまま天寿を全うできる可能性が高いので、
病態の進行や変化をすばやくキャッチして、臨機応変に対処できるだけの体制さえ整っておれば、積極的な治療をせずフォロー(監視)だけで様子を見るというのも賢いやり方かも知れません。
米国のデータでは、監視療法を選択した人の約2/3は、その後も積極的な医療に切り替える必要がなかったということです。
ただ、「がん」という言葉を始めて聞いた人の多くは、体内にがん細胞があるというだけで冷静さを失い、人生最大の危機に巡り合わせたように思って、
治療を急ぐ傾向があるのですが、積極的な治療にはかならず副作用がついて廻ります。
低リスクの場合には、がんの進行によって命が脅かされるリスクと、積極的治療によって副作用を被るリスクを比較すれば、
後者のリスクのほうが明らかに高いと思われる場合も多いので、
適切なフォローすなわち”監視療法”という選択肢も、積極的に評価されるようになってきました。
根治への切り替えを常に念頭に置いた積極的な「監視療法=active surveillance」では、PSAによる監視以外に、
生検も定期的に(1〜2年に1回程度は)必要とされていますが、近年はMRIによる検査の信頼性も高まっているので、
生検の実施に拘らず、MRIでも良いとなれば、監視療法も、もっと広がるのではないでしょうか。
高齢者あるいは期待余命が10年未満の場合に行われる「待機療法=watchful waiting」では、自覚症状がない限り、治療行為は一切行われないのが普通です。
米国ではPSA検診の普及が進み、実に8割を越える人がそれを受けていますが、近年、PSA検査でごく初期の小さながんが見つかる確率が増えてきて、
それが過剰検診や過剰治療につながる恐れが顕著になってきたことに加えて、医療費の抑制も併せて考えると、PSA検査を止めてしまうのが近道であるという乱暴な考え方が
米国政府にでてきて、厚労省もこの流れに沿って、PSA検診は不要という考え方を示しています。
PSAの検診受信率が2割にも届かない日本と、すでに8割を越えている米国を、同列に論じて良いものかどうかははなはだ疑問の残るところです。
むしろ患者にとって大切なのは、PSAの検査結果をどう評価し、どう動くかということでしょう。
「低リスク」がんでは、がんを死滅させることがベストとは限りません。不要な治療を受けることによって失うものがある可能性は高く、場合によっては一生抱えて生きなければならない重大な後遺症を背負うかも知れないのですから。
”監視療法”というのは、定期的(3〜6カ月ごと)にPSAの動向を見守ると共に、必要に応じて(1〜3年ごと)生検を行い、
根治の機会を留保したまま病態の進行を監視するもので、低リスクなら、まずはこの可能性を探ってみるべきでしょう。
生検は患者にとってなかなか辛い場合も多いのですが、MRIの進歩がこれに代わる時代がまもなく来るのではないでしょうか。
さもなくば、現行の腫瘍マーカーPSA(精度は高いが特異度は低い)に代わって、精度、特異度共もっと優れたマーカーが出現すれば(研究段階では色々と取り沙汰されています)生検の必要度も低下するかも知れません。
NCCNガイドラインでは「超低リスク」という概念を設け、これに相当するなら年齢に関係なく、監視療法が第一選択であると明言しています。
欧州では監視療法は「低リスク」の患者に対し幅広く適用されていて、監視療法の占める比率も米国よりずっと多いと言われています。
日本の医療機関では、まだこの監視療法を患者に詳しく説明しない所も多くあり、
患者が監視療法という選択肢を知らないまま、なんらかの処置を望んだ場合(患者に余程の予備知識がない限り、そう思う方が自然です)
安易に手術や放射線治療を勧めたり、内分泌療法を行うケースも珍しくありません。
「初期のがんですから、切ったらすぐ治ります。」と言われて不必要な手術を受け、性機能不全や排尿障害の後遺症に悩むというのは、
過剰治療の最たるものですが、一生続く場合もある日常の不幸にじっと堪え、それでも恨み辛みを言うわけでもなく、命が助かった代償なので仕方がないと諦めて、
手術をしてくれた医者に感謝するという、なんとも複雑で哀しい現実があるわけです。
積極的な治療には、多かれ少なかれ二次的な障害(副作用)を被る危険性があるわけですが、目の前に「がん」という言葉を付きつけられれば、たいていの患者は動揺し、
治療後長く続くかもしれない副作用の重大性になかなか気付かないケースが多いわけです。
期待余命の長さが10年以内(概ね75歳以上)なら「中リスク」でもこの監視療法が成立します。
期待余命が5年以内と目される高齢患者はもちろんのこと、他に重い病を抱えているような人は、もっと積極的に監視療法を選択肢に加えても良いのではないでしょうか。
恐れるべきがんであれば、早期にしかるべき治療を受ける必要があるのはもちろんですが、
ほとんど恐れる必要のないがんを恐れるあまり、自分自身に一生取り返しのつかない傷をつけてしまうこともあるわけです。
「沈黙は金」、「動かざること山の如し」、”何もしない勇気” を持つということも、時には必要なことかも知れません。
フォーカルセラピー(部分治療)
前立腺がんは1個の塊であることは珍しく、大小の塊が散っていることが多いのが特徴であり、
積極的治療を行うなら、前立腺全体を対象に治療を行うことが、実診療においては一般的となっています。
しかしながら、フォーカルセラピーというのは、臨床上重要と思えるがん(significant cancer)の塊だけを治療しようと言うもので、近年(ガイドラインでは2016年以降)、このような考え方が認知されるようになってきました。
低リスクのがんに対する過剰治療が問題視され、監視療法に注目が集まるようになりましたが、積極的な治療をしないことに不安を覚える患者は少なくありません。
このフォーカルセラピーは、監視療法と積極的治療の中間に位置するもので、積極的治療に伴う副作用を低減し、機能温存をしながら最小限の治療を行うという考え方です。
前立腺内に占める臨床上重要ながん(significant cance)の位置を特定できれば、前立腺全体でなくともその一部だけを治療すれば良いという考え方は古くからありましたが、治療をしない領域に、臨床的に意義のあるがんが残ってしまうリスクも高いので、現実的な治療法として認知されるまでにはかなりの時間を要しています。
近年、このフォーカルセラピーが現実味を帯びてきたのは、がん細胞の位置を特定する画像技術が著しく向上してきたからです。MRIの画像診断能力が向上し、MRI-超音波融合生検が行われるようになり、前立腺がん細胞の位置をリアルタイムで3次元的に把握できるようになってきました。
フォーカルセラピーに用いられる治療手技は、主に以下の3種類です。
・ 小線源治療
・ HIFU
・ 凍結療法
ただしフォーカルセラピーの症例数はまだ限られており、評価も定まっているとは言いがたい状況です。
治療後も前立腺は残っているので、PSAによる結果のフォローは明瞭ではなく、慎重に行う必要があります。
フォーカルセラピーの治療対象になるかどうかの評価も簡単ではないので、希望すればだれでもすぐに受けられるものでもありません。
これを行っている施設は、まだ一部の医療機関に留まっています。
本項では余談となりますが、これらの治療法は、限局再発前立腺がん患者の救済治療に用いることも可能です。
小線源療法
低線量率小線源療法(LDR)が単独で用いられることが多い。
治療の詳細は こちらから
HIFU(高密度焦点超音波療法)
HIFU(ハイフ)は、直腸に治療用のプローブを挿入し、高エネルギーの超音波を焦点に収束させ、概ね80〜100度の高熱でがん組織を破壊するもので、ここ数年機器の改良がなされ、治療成績もかなり向上してきました。
大げさな治療機械を要しないので、中小の医療施設でも対応が可能と思われます。
実施施設もやや増えてはいるものの、非再発率では小線源療法等に遅れを取り、標準治療と見なされるには至っていません。
適応は「低・中リスク」ですが、「低リスク」でPSAが低いほど成績が良いと言われています。
焦点を収束させる距離に限界があるので、肥大した前立腺には向いていません。
急性障害としては、前立腺の腫張に起因する排尿障害がしばしば見られ、
施術時に小規模な経尿道的前立腺切除(TURP)が行われる場合もあります。
体への負担は小さく、性機能障害も少ないようですが、まれに腸・膀胱の障害が発生することもあります。
再発時は再度HIFUを行うことも出来ますし、他の治療法を選択することも可能です。
入院期間は短く2〜3日、施設によっては日帰りも可能です。
ただし、医療保険の適用外であり全て自己負担となります。(80万円〜110万円程度)
凍結療法(クライオセラピー)
凍結療法とは、がん細胞を凍結させて死滅させる治療法で、前立腺が大きく肥大していると、適応とならない場合があります。
局所麻酔を行い、会陰部から病巣周囲に特殊なニードルを数本刺し込み、液体窒素もしくは高圧アルゴンガスを注入し、マイナス40℃以下に急速に冷却すると、がん細胞は凍結し壊死に至ります。凍結、融解を2回ほど繰り返す場合があります。
長期成績はまだ明らかではなく、保険適用とはなっておりません。
副作用としては、発熱、疼痛、血尿、尿漏、直腸凍傷の可能性があります。
再発時には治療を繰り返すことが可能であり、放射線治療後の再発症例に対し、
救済凍結療法を行う場合もあります。
手術療法
根治を狙う手術は、基本的には「限局がん」で期待余命が10年以上(米国では70歳、日本では75歳を目安とすることが多い)、かつ健康上特に問題のない患者が対象となります。
「低リスク」でリンパ節転移の可能性が特に低い場合除き、通常、骨盤内リンパ節郭清も同時に行なわれることが多く、このような手術を「全摘(術)」と称しています。
多くの医療機関は手術の対象を「限局がん」と考えていますが、一部の医療施設では、少数のリンパ節転移のある局所進行がん(T3:浸潤がん)に対しても、
リンパ節を広範に郭清する「拡大手術」が行われています。
我国では約7割の前立腺がん患者が手術療法を受けていますが、米国や欧州では放射線治療の方が断然多く、手術はせいぜい3割程度でしたが、
2012年、前立腺がんに対するロボット支援手術が保険適用となって以来、急速に普及してきました。(2017年末現在:国内で約270台)
がん病巣は切って捨てるのが一番確実であり、手術でを取り除けば治るはずと思っておられる方も居るようですが、「限局がん」でも2〜3割の方が再発されているのが現状です。
医師から告げられる「限局がん」と言う言葉は、実際にがんが前立腺内部に留まっているという意味ではありません。
画像検査ではそのように見えているという意味であり、この時点での病期は「臨床病期」というものであり、実際に「限局がん」であるかどうかは、腹を切ってみて、病理検査の結果(病理病期)と照合しないことにはなんとも言えません。
同じ「限局がん」でも、高リスクになるほど、実際は前立腺の皮膜外に進展したり、リンパ節に転移がある可能性が高くなり、そうなるとなかなか簡単に取り切れるものではありません。ごく大雑把ですが、低リスクでも1〜2割、中リスクで2〜3割、高リスクでは多くの病院で5割以上が再発していると思わなければなりません。
近年盛んになりつつあるロボット手術を、我国で最も早く導入し、治療症例が最多の医療施設でも(T医科大)、高リスクに対しては3人に2人が再発しているのが実情です。
ロボット手術が保険適用となって以来、多くの施設がロボットを導入し、患者にロボット手術を勧めることが増えていますが、高リスクがんでは特に注意が必要です。
「放射線治療と比べてほとんど同じ、ご自分で選んでください」と言われることが多いようですが、「ほとんど同じ」というのは死亡率のことであり、非再発率には相当な開きがある場合も少なくありません。
術後3週を経過してもPSAが下がりきらない時は、放射線療法によるリカバリー照射も選択肢の一つとなってきます。
初回の放射線治療は高精度かつ高線量照射が普通となってきましたが、
リカバリー照射というのは、すでにターゲット(前立腺)がなく、正常な臓器を痛める恐れが強いので、通常、線量は下げざるを得ず、治療効果も初回の放射線治療には遠く及びません。
(一部の医療機関では、直腸などを避けながら、前立腺床に70Gyを越える照射をしているところもあります)
術前(ネオアジュバント)内分泌療法は米国では有用性は確立されていないとしてあまり用いられておりませんが、日本ではめずらしくありません。
手術の合併症として最も多いのは性機能不全です。
近年は、勃起神経温存術も増えてきましたが、(勃起神経同時移植術をやっている施設もあいますが、効果のほどはあまり芳しくはないようです。)がんの発生部位等諸条件によっては、神経温存が可能とは限らないし、温存したからと言って(両側共温存できる場合もあれば、片側だけの場合もある)
必ずしも好結果が得られるわけでもありません。
しかし、尿失禁に対しては比較的良好な結果が期待できるという副産物もあるので、神経温存が可能ということであれば、それを希望されても良いのではないでしょうか。
尿失禁は短期的には必発と思って良いでしょう。数週間から数カ月で状態が改善することが多いのですが、まれに長期化して辛い目を見ることもあります。
また、鼠径ヘルニアの発症も珍しくなく、広範囲のリンパ節郭清を伴う場合は、下肢にリンパ浮腫が生じる場合も少なくありません。
頻度はさほど多くないと思いますが、手術によって尿道粘膜に傷がつき、修復過程で線維化や瘢痕化という異常が起こり、尿道狭窄を生じる場合もあります。
これらの副作用については 「後遺症」(未完) をご覧ください。
開腹手術
日本では、以前は全摘術と言えば開腹手術が主流でしたが、ロボット支援手術が保険適用となってからは、ロボット支援手術が増え、開腹手術は減る傾向にあります。
開腹手術には、下腹部を縦に(or横に弓なりに)切る恥骨後式と会陰部(肛門と陰嚢の間)を小さく切開する会陰式があります。
骨盤内リンパ節郭清を必要としない場合は、体への負担が少なくかつ性機能も温存しやすい会陰式が用いられることもありますが、
我国では恥骨後式が圧倒的に多いと言われています。
入院期間は、重要な合併症がなければ約10日ぐらいでしょう。
腹腔鏡手術
腹腔鏡手術というのは、腹部に手術器具を挿入する小さな穴をいくつか開け、その穴から手術器具を突っ込んで行う手術方式です。
臓器摘出用としてやや大きめの穴(切開創)が必要となります。
腹腔内で手術スペースを確保するため体内にガス(CO2)を注入し加圧します。
腫瘍の制御に関しては開腹手術と同等ですが、回復、入院期間の短縮、痛みや失血量の減少、
手術創が小さいなどがメリットで、開腹手術に比べ患者の負担はかなり改善されています。
ただ、執刀医の腕に左右されることが多いので、患者としても注意が必要です。
2006年4月より健康保険で行われるようになりました。
小切開(ミニマム創)手術
腹腔鏡手術の変形スタイルです。腹腔鏡手術でも病巣組織の摘出にはやや大きめの穴が必要ですが、これに相当する3〜5cm程度のミニマム創1カ所からすべての手術を行うもの。
腹腔内にガス(CO2)の注入を要さず、状況に応じて創の長さを調節できるので、腹腔鏡手術に比べて安全性が高いと言われています。
2008年4月より腹腔鏡下小切開手術として健康保険が効くようになりました。
これも医療機関(執刀医)によって得手不得手があります。近年は3Dの高倍率拡大鏡が用いられるようになってきて、視野の共有も可能となっています。
ロボット支援手術の欠点である「触覚」も、これらの手術では確保されていますが、習得にはかなりの時間を要します。
腹腔鏡やミニマム創手術のベテラン医師には、この方式に拘りを持ち、高度で丁寧な手術をする方もめずらしくありません。
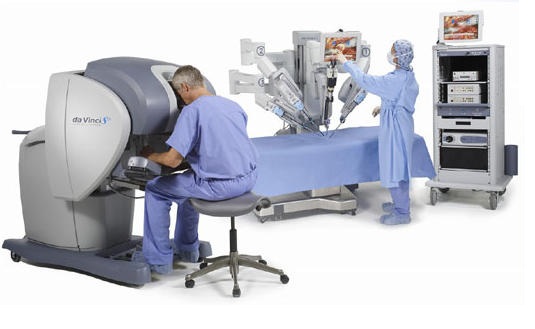
ロボット支援手術
米国では前立腺全摘除術のほとんど(95%)が遠隔操作によるロボット(ダ・ヴィンチ)支援手術となっていますが、
我国では、手術用ロボットの導入は米国よりかなり遅れて始まり、2012年4月に、前立腺がんのロボット支援手術が保健適用となったのを契機に、急速に普及しました。
2012年春には30数台に留まっていたものが、2013年10月には約130台、2017年末には270台に達したようです。
コンソール(操作卓)に向かった医師が、ズームの可能な3D画像を見ながら、人間の手首よりも広い可動範囲を持つロボットの鉗子を操作し、
手の震えを防いだり、指先の動きを縮小伝達できるので、微小な操作もやり易く、失血量の減少と共に(炭酸ガスで圧をかけると出血は減る)輸血を要するケースも減ってきました。
腹腔鏡手術がかなりの手技を必要とするのに対し、たとえ手先が不器用でも、ロボットの操作性がそれをカバーしてくれるので、術者の養成が楽であり、
総じて低侵襲と言われていますが、非再発率の改善など根本的な部分での優位性は米国でもまだ実証されておりません。
ロボット支援手術は低侵襲で体に優しいという言葉を聞く機会が多いかも知れませんが、それは開腹手術と比較しての話であり、
放射線治療(外照射&小線源)と比較して低侵襲という意味ではありません。
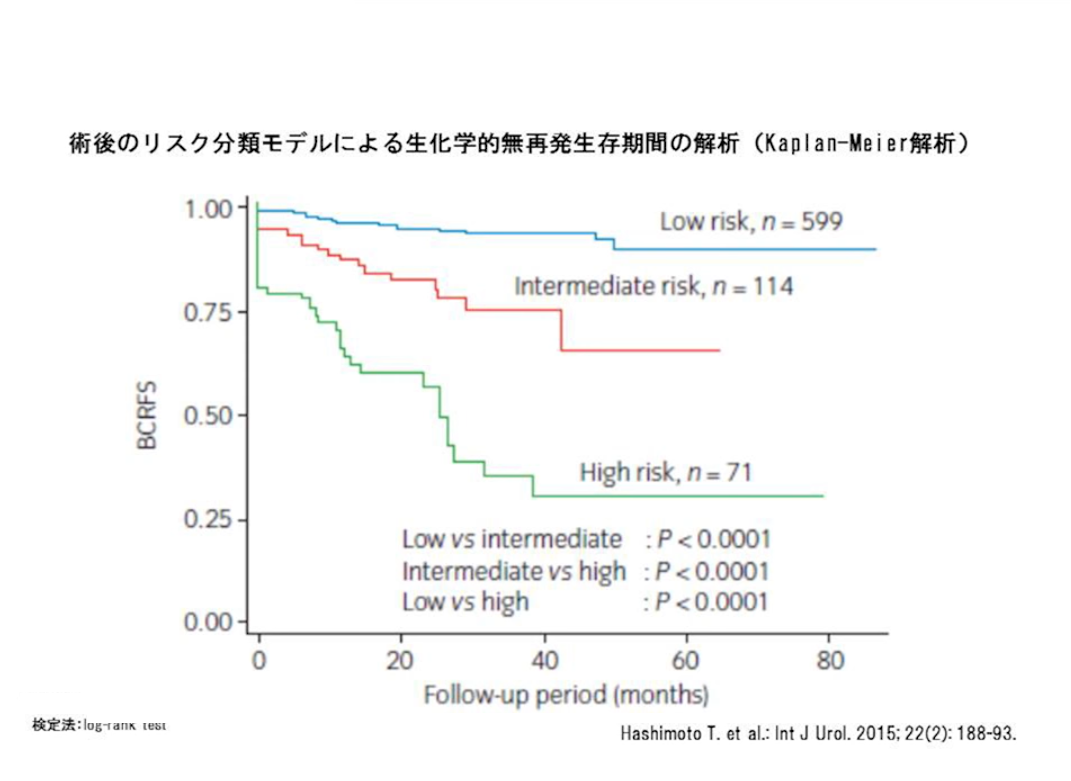
ロボット支援手術の治療成績で5年非再発率が明らかになっているのは、日本では、保険適用となる以前からロボット支援手術を導入し、症例数も日本最多の東京医科大学病院しかありませんが、
その成績は、開腹手術や腹腔鏡手術と比べて決して優れているとは言えません。特に「高リスク群」では悪いようで、5年非再発率は30.3%しかありません。なんと7割が再発しているのです。
手術をしたいが開腹手術は嫌だ、ロボットにしたい!という声も良く効きますが、最先端のハイテク治療が「治癒」を約束してくれると思うのは、どうやら思い過ごしに過ぎないようです。
2020年、国産の手術支援ロボット「火の鳥」が生まれました。今後「ダヴィンチ」を追いかける立場になると思うのですが、 ロボットが外国製か国産かということより、患者にとって有益なのかどうかという視点で、引き続き注視していきたいと思っています。
放射線療法
前立腺がんは放射線治療に向いているがんの一つで、米国では今や前立腺がん治療の約7割近くを放射線治療が占めています。
放射線療法には大きく分けて外部照射と内部照射があります。
まずは外部照射ですが、リニアックを用いた旧来の2次元照射では、照射線量をせいぜい66〜68Gy程度までしか上げられないため、治療効果は限定的で、
初期治療としては、今やほとんど用いられておりません。
(一部の泌尿器科医は、放射線治療の技術レベルを、現在もこの程度だと理解しておられるようです)
現在では、前立腺を3次元のターゲットとして多方向から照射する3次元原体照射では概ね70〜74Gy程度、
IMRT(強度変調放射線治療)ならば74〜80Gy程度の(84Gy程度まで線量を上げている施設もあります)高線量照射を安全に施行することが可能となっており、
高いビームエネルギーのマシンによる高線量照射であれば、治療成績も決して手術(全摘術)に劣ることはありません。
また、これらに用いられる放射線はすべてX線ですが、陽子線や重粒子線を用いた粒子線治療もここ10数年の間に大きく普及してきました。
内部照射には、低線量率組織内照射(LDR:ブラキセラピーor小線源療法)と高線量率組織内照射(HDR)の2種類があります。
近年我国では小線源療法(LDR)の増加が目覚ましく、これによって放射線治療全体の治療例数もかなり増えてきましたが、
放射線治療を行う診療科があるにも関わらず、手術が圧倒的多数を占めている医療施設も、まだ珍しくありません。
「超高リスク」の場合、放射線療法と言う選択肢も示されないまま、ホルモン療法を提示されるケースもありますが、
内分泌療法を併用したIMRT(強度変調放射線治療)やトリモダリティ(小線源療法+外部照射+内分泌療法)も選択肢の一つであることを忘れてはなりません。
一部の医療施設では、少数の骨転移やリンパ節転移がある場合でも、根治の確率は低いとしても、生存期間の長期延長を狙って、
広範囲照射と同時に転移個所に高線量を照射する積極的治療が行われるようになってきました。
外部照射
前立腺は体の深部にあるため、外部照射には高いビームエネルギーが必要とされ、また前立腺の上面は膀胱、背面は直腸と接しているため、
がん病巣のある前立腺には高線量を照射しながらそれらの臓器を避けるという高精度の技量が要求されます。
外部照射では、すべてのリスク群において、前立腺に当てる線量が増えるほど、生化学的再発が少なくなることが、ランダム化比較試験で分かっていますが、
古くから行われてきた2次元照射では、限局部の線量を上げようとすれば、他臓器に障害が出やすくなるため、どうしても一定以下の線量に抑えざるを得ませんでした。
したがって、このような照射は、疼痛緩和や予防照射で用いられる場合を除いて、今ではほとんど出番が無くなりました。
今日では、3次元原体照射(3D-CRT)、IMRT、粒子線治療等が前立腺がん治療の外部照射として用いられ、
限局部にできるだけ高線量の(日本では72〜80Gyぐらいが多いようです)照射を行いつつ、
いかに隣接臓器の二次障害を小さく押さえることができるかが、腕の見せどころとなっています。
IMRTを実施している施設は、私ががんを患った2014年には10数か所しかなかったのですが、現在はすでに140個所を越えています。(2015年末現在)
近年は、少数の転移がある場合でも、広範囲照射と同時に局所のブースト照射もおこなえるSIB-IMRTなどという照射方法も試みられるようになってきました。
粒子線治療は重粒子線を用いるものと陽子線を用いるものとがありますが、
前立腺がんの場合、X線より粒子線治療のほうが好ましいという積極的な理由はどこにも見当たりません。
陽子線治療とIMRTは米国ではほぼ同等とみなされています。
重粒子線の治療成績は、陽子線よりは良さそうですが、それでもIMRTのTOPクラスの成績を明白に上回るものではありません。
(超)高リスク群に対する内分泌療法の併用は、照射前(ネオアジュバント)だけに留めるか照射後(アジュバント)も続けるかは
医療機関によって考え方が異なりますが、近年は照射後も数年継続する施設が増えてきているようです
(内分泌療法の期間は、トータルで2年〜3年程)。
高精度外部照射の治療効果はいずれも手術と比べて遜色がなく、直腸出血や血尿などの晩期後遺症の発生も少なくなってきました。
性機能については、精液の量の極端な減少を除けば、実感としてはほとんど問題はありませんが、数年かけてゆっくり性機能障害が進行する場合が多いようです。
比較的高齢者が多いこともあり、それが放射線による二次障害なのか、高齢化に伴う性機能の退化なのか、判断が微妙なケースも多いと思われます。
QOL(生活の質)は概して手術より優れています。
放射線治療はがん細胞を瞬時に焼き殺すわけではなく、がん細胞、正常細胞のいずれに対してもそのDNAの一部を損傷するというダメージを与えます。
ところが正常細胞のダメージ修復力はがん細胞に勝っており、その修復力の差を利用し、
一回に2グレイ程度の分割照射を繰り返し行うことで、正常細胞を保護しつつがん細胞だけの自滅(アポトーシス)を狙うわけです。
外部照射は2Gy/回の分割照射とすることが多く、治療期間の長い(7〜8週)のが難点ですが、
近年は一回の線量を増やして治療期間を短くする寡分割照射も徐々に増えて来ました。
2.5Gy〜3.0Gy程度の小幅線量増加では、副作用も通常分割とほとんど変わらないという結果がでています。
「(超)高リスク群」では手術よりもIMRT等の高精度外部照射のほうが治療成績が上回っており、
近年はトリモダリティ(外部照射併用+小線源療法+ホルモン療法)も、高精度外部照射と並んで
(小線源と外照射を併用すれば、前立腺に非常に高い線量を照射できることが特徴です)注目される治療法となってきました。
「(超)高リスク群」では、ノモグラムで分かる通り、画像に現れない微小な浸潤や転移のあることが十分予測されるわけですが、
前立腺を中心に狙いを定める場合と、広範囲な照射を組み合わせる方法があるようですが、結果には大差はないようです。
従来から経験的に知られている効果としては、限局部の放射線量が多いほど、近傍も含めたがん全体の制御率が向上するということです。
限局だけの照射でも、その周辺にはある程度の放射線は当たらざるをえないので、臓器移動等によるマージンの設定も含めて
高線量のターゲット周辺にはややファジーな線量ゾーンが存在するわけですが、それがなんらかの意味で良い効果を与えているのではないかと思われています。
我々の体内では、毎日数千のがん細胞の芽が誕生し(細胞分裂時の遺伝子のコピーミスと言われています)、
それを体に備わった免疫システムで日々やっつけるということを延々と繰り返しており、
その免疫システムからうまく逃れた複数の異変が集積し成長してきたのががん細胞と言われています。
ところが、がん細胞に一定以上の放射線を当てた場合、体の免疫システムに対し、
がん細胞が「異物」であるという認識を与える働きがあることが判って来ました。
周辺部のがん細胞に対し、それが異物であるという標識を付け、免疫システムががん細胞に襲い掛かり死滅させるよう仕向けるには
どの程度の線量が最低限必要なのか、まだ詳しくはわかっていませんが、実験をしてみたところ、
放射線をあてた部分に免疫細胞(マクロファージ)が集まる様子が顕微鏡でも確認できるとか。
切れ味という意味では粒子線に劣るという話もありますが(ターゲットが動かないことを前提にした場合)
がん細胞が潜んでいるかもしれない周辺ゾーンへの「意図しない」ファジーな照射が、案外効果的に働いているのかも知れません。
T3(病期C:浸潤がん)の前立腺がんにおいて、放射線治療の方が全摘術より優位に立てるのはこのあたりの事情に負うところが大きいように思われます。
日本放射線腫瘍学会・・・JASTRO認定施設、放射線治療専門医を探す
(日本地図の該当地域をクリック)
大船中央病院 放射線治療センター・・・説明が詳しく分かりやすい
IMRT(強度変調放射線治療)
IMRTと言うのは、シミュレーション(位置決め)に基づき治療計画を施す際に必要とされる複雑な計算を、
コンピュータの助けを借りて行い、正常組織への照射線量を抑えつつ腫瘍部分に高線量の放射線を照射できる技術で、日本では今世紀になってから始まりました。
リニアックに備わったMLC(多分割コリメータ)をコンピュータ制御により高速で動かし、
一方向からの照射線量に濃淡をつけることにより、計算どおりの線量分布を実現します。
ただ、コンピュータ制御と言っても、全て機械まかせではありません。
動く被射体をどのように制御し、どれだけのマージン(許容誤差)を見込むべきか、これらは照射技術の問題となります。
IMRTで多いのは、5門ないし7門の固定照射(アームは回転しますが、一定の角度で止まってから照射します。)ですが、
回転しながら照射をおこなうIMRT専用機も増えて来ました。
IMRTでは、放射線治療医が治療計画を立てることが、外科医により手術と同等の作業を意味します。
治療計画を立てたり放射線量を厳密に管理するには、放射線治療医と医学物理士の協働が欠かせませんが、
共に人材が不足しているのが現状であり、同じIMRT実施施設と言っても、その実力にかなりの開きがあるのが現実ではないでしょうか。
IMRTの治療には半年前後の待機も珍しくありませんが、患者はその期間を利用して内分泌療法を受けることが可能です。
IMRTは2008年4月より健康保険扱いとなり、より身近なものとなりました。
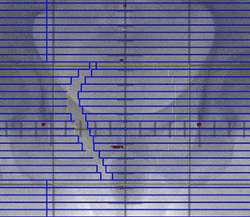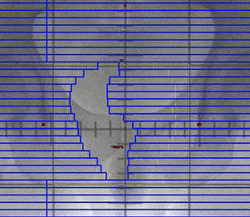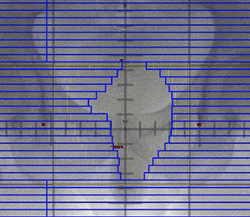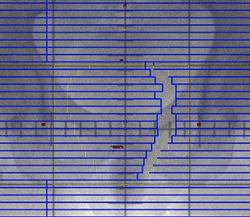
← マルチリーフコリメータの作動イメージ
(一方向からの線量に濃淡をつける)
IGRT(画像誘導放射線治療)
IGRTとは、画像誘導によって位置決めをおこなうIMRTのことです。
放射線治療の開始直前にCT や超音波、X線撮影等を行い、
その画像を位置決め時の画像と重ね合わせて、腫瘍位置を確認しながらターゲットに照射するのがIGRTです。
位置合わせを、より厳密にすることにより、正常組織への照射を避けながら、がん病巣への照射精度を上げようとするもので、
照射マージン(誤差を考慮した逃げ幅)を縮小することにより、有害事象の低減を期待するものです。
IGRT で正確な位置合わせを行うため、前立腺に小さな金マーカーを埋め込む場合もあります。
(埋めこまなくとも高精度な照射が可能な方式もあります)
近年、新しい放射線治療機器(ノバリス・トモセラピー・シナジー・VMAT・Vero 4DRT等)が次々と登場しており、これらは、
位置合わせや治療計画の手間を減らしたり、照射時間を短縮するなど、画像誘導装置による様々な利点を備えたIMRTの専用機と言えます。
しかし、手動でピント合せるカメラよりオートフォーカスのほうが、カメラとしては進歩しているでしょうが、写真の出来栄えは写す人しだいです。
上等なゴルフクラブでも、ヘタな人が振り回せばなんの役にも立たないのと同様、日本には「宝の持ち腐れ」という言葉もあります。
某有名人がトモセラピーによる治療をうけたと言うことがニュースで知れてからは、
「IMRTではなくトモセラピー(実はこれもIMRTです)にしたい」という患者さんが増えたような気がしますが、
これは少し単純すぎる発想かも知れません。
要は使う人(もっと正確に言えば治療計画をする人)の腕しだいですが、
技量が十分備わっているかどうかを見抜くことは、我々患者にはなかなか容易ではありません。
参考となるのは、JASTRO(日本放射線腫瘍学会)のサイトに載っている、JASTRO旧認定施設と放射線治療専門医名簿ぐらいでしょうか。
ただしこれは必要条件であり、十分条件ではありません。
オリゴメタ(少数転移)
従来は、近傍のリンパ節転移はともかく、骨転移があればすでにがん細胞が血流に載っていると考えられるので、
積極的な治療は意味をなさず、ホルモン療法しか選択肢が無いと思われていたのですが、 現在は、
一旦血流に乗ったがん細胞でも、骨に住み付き定着するのには、それ相応の苦労をしており、
どこでも簡単に定着できるとは限らないので、 転移の位置や個数、がんの成長スピードなどの諸条件にもよりますが、
転移巣が少ない場合には、根治ないし長期延命を狙った放射線治療を試みる価値があると考えられるようになってきました。
前立腺がんの場合は、原病巣の進展が比較的ゆっくりしている場合が多いことも、オリゴメタ(少数転移)の治療には有利な条件になると思われます。
コンピュータによって高度に制御されたIMRTでは、広範囲照射と同時に数か所の転移部に的を絞ったブースト照射を行う事が可能で、
この技術は SIB-IMRT(標的体積内同時ブースト強度変調放射線治療)と呼ばれています。
ただ、IMRT系の技術というものは、遠隔転移のある場合には保険適用が難しいという規定になっています。
これは技術の進歩に法令が追いついていないということです。
自由診療でこれを行う放射線治療専門クリニックもあれば、あえてIMRTを用いずに、同様の治療を保険範囲内でやっている施設もあるのが現状です。
先進的な治療を考えている医療施設では、患者が比較的若くかつ諸条件が整って居れば、オリゴメタ(少数転移)に対しても、このようなテクニックを用いて、
積極的な治療が試みられるようになってきました。
がん情報サービス・・・前立腺がん治療施設が表示されるので
>絞り込み検索の”IMRT”にチェック >「再検索」をクリック
「オリゴメタ(少数転移)の治療」・・・市民のためのがん治療の会
粒子線治療(陽子線・重粒子線)
粒子線治療には「陽子線治療」と「重粒子線治療」があり、概ね良い治療成績をあげています。
しかし、IMRTなどの外部照射の良好な施設との比較では、それを凌ぐ明らかな証拠は見当たりません。
粒子線は「ブラッグピーク」を持つため、飛行線上のある一点(体の深部)で大きなエネルギーを放出し、後はストンと消滅してしまいます。
こうした粒子線特有の物理的性質があるため、周囲の組織への影響を最小限に抑えながら、ターゲットにも高線量を集中させやすいわけですが、
前立腺の位置は一定ではないので、これをいかに制御し誤差を最小限にするかという照射技術を伴う必要があるので、物理的特性が優れているというだけで、治療の優劣が決まるわけではありません。
以前は、照射方式ではX線に劣っているのがほとんどでしたが、近年はかなり工夫が凝らされ、精度も上がりつつあるようです。
重粒子線の破壊力(がん殺傷力)は、X線や陽子線より強力ですが、前立腺がんの治療効果においてはさほど大きな違いはありません。副作用を一定に押さえようと思えば、生物学的等価線量はほぼ同等とならざるを得ないからです。
最近、粒子線治療の新しい施設が増えつつありますが、安定した治療を行うには一定の習熟期間が必要となるため、
新設後1〜2年は避けた方が賢明といえるでしょう。
陽子線の照射回数は、施設にって異なりますが、概ねX線の寡分割照射程度であり、重粒子線の場合は超寡分割照射程度と考えて良さそうです。
粒子線治療は、長らく先進医療(*注)として扱われており、治療費は重粒子線で約310〜320万円、陽子線で約280万円前後が必要でしたが、2018年の春より、前立腺がんに関しては保険適用が可能となりました。
2015年には、重粒子線治療施設は4個所、陽子線治療施設は10個所(内1個所は両方の治療が可能)でしたが、2019年には、重粒子線:6個所、陽子線:17個所(内1個所は両方の治療が可能)に増えています。
組織内照射(小線源療法:ブラキセラピー)
前立腺がんの組織内照射は、小さな密封線源(I125:ヨー素125)=シードを前立腺に永久的に埋めこむブラキセラピー(低線量率小線源療法:LDR)と、
一時的に高線量の線源(Ir:イリジウム)を送りこむ高線量率小線源療法(HDR)の二通りがあります。
多いのは圧倒的にブラキセラピー(LDR)ですが、医療施設によって、得意とするやり方が違っています。
低リスクと中リスクの一部ではLDR単独で用いられることが多く、高リスク(または一部の中リスク)ではLDR・HDR共、外部照射との併用が一般的です。
低線量率小線源療法(LDR)
数種類の呼称がありますが、一般的には小線源療法もしくはブラキセラピーと呼ばれています。
ただし、ブラキとは「近接した」という意味なので、厳密には「低線量率」だけを意味するものではりません。
前立腺内にシードと呼ばれる放射性の密封線源(ヨウ素125等)を永久留置する治療法なので、シードインプラント法と称されることもあり、
2003年7月に認可がおり、我国でも使えるようになりました。
米国では、当時すでに十分実績のある治療法でしたが、放射線源を体内に留置するため、日本では放射能管理上の問題で、長らく認められなかったという経緯があります。
入院期間はわずか数日(欧米では日帰りも)、体への負担や副作用も比較的少なく、前立腺がん治療を大きく変えたと言われています。
小線源療法は、単独で用いられる場合は、「低リスク」もしくは「低に近い中リスク」が対象となり、治療効果も手術や外部照射に引けを取りません。
NCCNガイドライン2014では、小線源療法(単独)の適応範囲を中リスク全体にまで広げていますが、我国での平均的なレベルではまだそこまでには至らないようです。
放射線治療医が治療計画を立てて、必要なシードの本数を決定し、その都度米国から輸入しているのが我国の現状です。
埋めこみにはかなりの熟練を要し、通常は泌尿器科医がこれにあたっています。
リアルタイムプランニングを用いながら線源を、主に前立腺の外周近辺に配置することにより、多少の浸潤をカバーしながら、同時に尿道の線量を抑えるという器用な施術をされる医師もあれば、
前立腺内にランダムにシードを配置するしかできない医師もおられます。
小線源療法単独でも外部照射を大きく上回る照射線量を確保できる医師もあれば、
実際「低リスク」に対応できる程度の低い線量しか与えられない医師もおられて、医療施設による差というよりは、医師個人の技量差が大きいようです。
前立腺がんの解説書でも、小線源(単独)療法については「低リスク限定」と書かれていたり、
泌尿器科の先生でも、小線源療法と言えば「低リスク」限定と信じておられる方もまだまだ多いようですが、
それはこの治療法が日本に入って来た10数年前のことであり、その時の記憶を引きずっているだけと思っていただいて良いでしょう。
外部照射では変動する前立腺の「位置合わせ」に気を配ることが多いのですが、小線源療法では直接前立腺内に埋めこむので、その心配のないことは大きな利点といえましょう。
実施施設も保険適用となった当時(2003年)よりずいぶん増え、2014年現在で約140施設ありますが、近年はロボット手術に押され気味で、伸びにも陰りが出てきたようです。
しかしながら、人気のある医療施設では治療希望者が多く、数ヶ月治療待ちの状態が続いているとか。
小線源療法は、前立腺が大きく肥大している患者には(一応の目安は40ccぐらいとされています)適応できませんが、
内分泌療法で前立腺を縮小させてから行う場合もあります。
前立腺が大きすぎると、恥骨の蔭に隠れてシードの埋め込みがしにくくなることと、シードの本数が増えすぎると、放射線管理上の上限値を越えてしまう恐れがあるからです。
肥大に伴う排尿困難がある場合や、前立腺肥大の治療として「経尿道的前立腺切除術:TURP」など尿道を広げる手術をしている場合には、適用外となる可能性もあります。
日本で小線源療法の治療実績が最も多いのは、東京医療センターです。
副作用としては、前立腺が腫れたり尿道の炎症による排尿困難が最も多く、切迫感、頻尿、血尿なども考えられますが、ほとんどの場合は数ヵ月で改善します。
まれながら直腸障害・膀胱障害もないとは言えません。手術に多い性機能障害や尿失禁は少なく、全体的にQOL(生活の質)は良好と言えます。
線源(シード)は体内に永久留置されますが、ヨウ素(I125)の半減期は約60日であるため、放射線量は時間の経過と共にどんどん減っていきます。
6ヶ月で当初の1/8、1年では1/64というまったく問題外の線量になります。
半年ぐらいは幼児を膝に抱くなどの動作は控えたほうが良いと言われていますが、どうしても孫がかわいくてたまらないなら、放射線防護用のパンツも市販されています。
ただし、ママにしかられぬようご用心を。
性行為は1ヶ月ほど経過しておれば特に差し支えはありません。
まれに線源が前立腺外へ脱落し、体外に排泄されることもあるので、コンドームの使用が推奨されています。
高線量率小線源療法(HDR)
日本では低線量率小線源療法(LDR)が未認可の頃から、一部の医療機関で用いられてきた治療法で、
アフターローディング法とも呼ばれる通り、会陰部より前立腺に対し一時的にガイド針(アプリケータ)を刺し込んた後で、高線量率線源(イリジウム192)を送り込みます。
「中・高リスク」の症例に対して用いられることが多く、大阪大学など一部を除き外部照射の併用が標準となっています。
実施施設はブラキセラピー(LDR)に比べて少なく(約20施設)、単に小線源療法と言う場合は、
多くの場合、前述の低線量率小線源療法と思っていただいて良いでしょう。
LDRは、半年ないし1年という時間をかけて、ゆっくり放射線を出し続けるのに対し、HDRでは、短期に放射線を集中照射するので、進行が早いと懸念される病状に対しては、LDRより優位な場合も考えられます。
また、LDRでは、シードを前立腺内の被膜に近い位置に綺麗に埋め込むには、一定以上の熟練した手技を要するのに対し、HDRでは先に数本の細管を差し、その中に線源を送り込むので、線源の脱落の恐れはなく、線源を留める位置と滞留時間については、ソフトウェアがカバーしてくれるので、施術者は比較的楽であると言われています。
副作用はブラキセラピー(LDR)とほぼ同じですが、線源が体内に残らないので、退院後は放射線に対する気使いは一切必要ありません。
入院期間は、外部照射を別とすれば数日から長くとも1週間以内でしょう。
術者・家族への被爆の危険度はLDRに比べて少ないと言われていますが、線源の挿入は複数回(2〜3回)に分かれることが多いので、
翌日の施術時までアプリケーターを刺したままで、ベッドの上で(移動に便利なようにスライダーの上で横たわる場合も)、
同じ体位を保ったまま動けないのが患者には相当苦痛となるようで、「まるで拷問のようだった」という体験者もおられます。
米国では一回の高線量照射で治療を終えてしまう施設もあり(UCSFなど)、日本でもいくつかの施設がこれに倣うようになってきましたが、1回で治療を終えることができれば、患者にとっては大変ありがたいわけですが、長期的な安全性はまだ実証されておらず、1回での治療の普及にはまだ時間がかかりそうです。
将棋の米長邦雄さん(故人)や間寛平さんもこの治療(HDR)を受けられています。
大阪大学病院 http://www.med.osaka-u.ac.jp/pub/radonc/www/microselectron.htm
トリモダリティ
中・(超)高リスクを対象とする場合は、外部照射を併用するのが普通です。
中リスクはともかく、(超)高リスクであればさらにホルモン療法を加えるのが普通で、
「小線源+外照射+ホルモン療法」という3つの治療をワンセットで行うという意味で「トリ・モダリティ」と呼ばれています。
外部照射を併用すれば、短期間で治療できるというメリットが薄れる変わりに、照射線量を飛躍的に増大させることができます。照射線量が多いほど、前立腺がんの治療成績(非再発率)も良くなると言われていますが、生物学的線量では、IMRTなどの外部照射を大きく上回ることができ、治療成績(非再発率)を押し上げることができるわけです。
近年トリモダリティの治療成績の良さが注目されていますが、我国では、これができる医療施設はまだ少ないのが現状です。
転移さえなければ、少々の被膜外浸潤があっても、トリモダリティの治療対象と考えて差しつかえありません。
精嚢浸潤に対しては、LDRでは小さいシードを精嚢内に埋め込むことは概ね困難なので(できる医師もおられますが)、多くの場合はHDRのほうに利点があります。
余談ですが、10年前に私(ひげの父さん)が浸潤がんの治療法を探していた頃には、IMRTという治療法は一般向けの解説書にはまったく載っていなくて、泌尿器科医の多くは、その存在すら知らなかったように思います。現在、IMRTはほとんどの泌尿器科医が知るところとなりましたが、ちょうど昔のIMRTのような位置にあるのが、今のトリモダリティではないでしょうか。
しかし、診断時にす明白な浸潤やリンパ節転移があるような場合には、トリモダリティで用いられる外放射は比較的単純で線量も低いので、IMRT(ホルモン療法併用)のほうがやはり適切かと思われます。
「トリモダリティ」という言葉は、近い将来多くの泌尿器科医に知られるようになるかと言えば、それはまた別の話であり、かなり難しいかもしれません。
小線源治療そのものが、放射線治療医と泌尿器科医の協力の基で成り立つ治療法ですが、我国では残念ながら放射線治療科と泌尿器科が良好な協力関係がある医療施設は、患者の想像以上に少ないのが実情です。
一般向けの解説書で「トリモダリティ」という言葉が用いられたのは、2013年に発刊されたこの本が最初です。
「前立腺ガン 最善医療のすすめ」(藤野邦夫著)
この本の批評は別に書かせていただきました。・・・トリモダリティなど創小線源の解説には力が入っているものの、IMRTなどの外照射に対する評価は低すぎており、多少取材の強弱に偏りがあると思っています。
http://higepapa.blogspot.jp/2013/06/blog-post.html
小線源治療については泌尿器科医の間にもは誤解や無理解も多いので、
もし主治医から「小線源というのは低リスクにしか使えない」というような説明を聞いた場合には
「そこの医療施設ではやっていない」という意味に解釈していただければ結構です。
IMRT同様、施設によって技術的な開きが大きいので、小線源療法をやっている医療施設なら、
どこでもトリモダリティができるというわけではありません。
もし手助けが必要なら、直メールをいただければ、可能な限りご協力をさせていただきます。



