4:全身療法で共存をめざす
PAGE CONTENTS
■ 全身療法となる進行がん
● 転移がん
・オリゴメタ(少数転移)
● 再発がん
・手術後の再発
・放射線治療後の再発
■ 薬物療法
・前立腺がんと男性ホルモン
・外科的去勢と内科的去勢
・去勢抵抗性前立腺がん:CRPC
・薬物療法の種類
● 内分泌(ホルモン)療法
・LH-RH製剤(ADT) :A
・抗アンドロゲン剤 :B
・アンドロゲン合成阻害剤 :C
・その他、旧来の内分泌療法 :D
● 化学療法
・従来型(殺細胞性)抗がん剤:E
・分子標的薬
・免疫チェックポイント阻害剤
・がんゲノム医療の時代へ
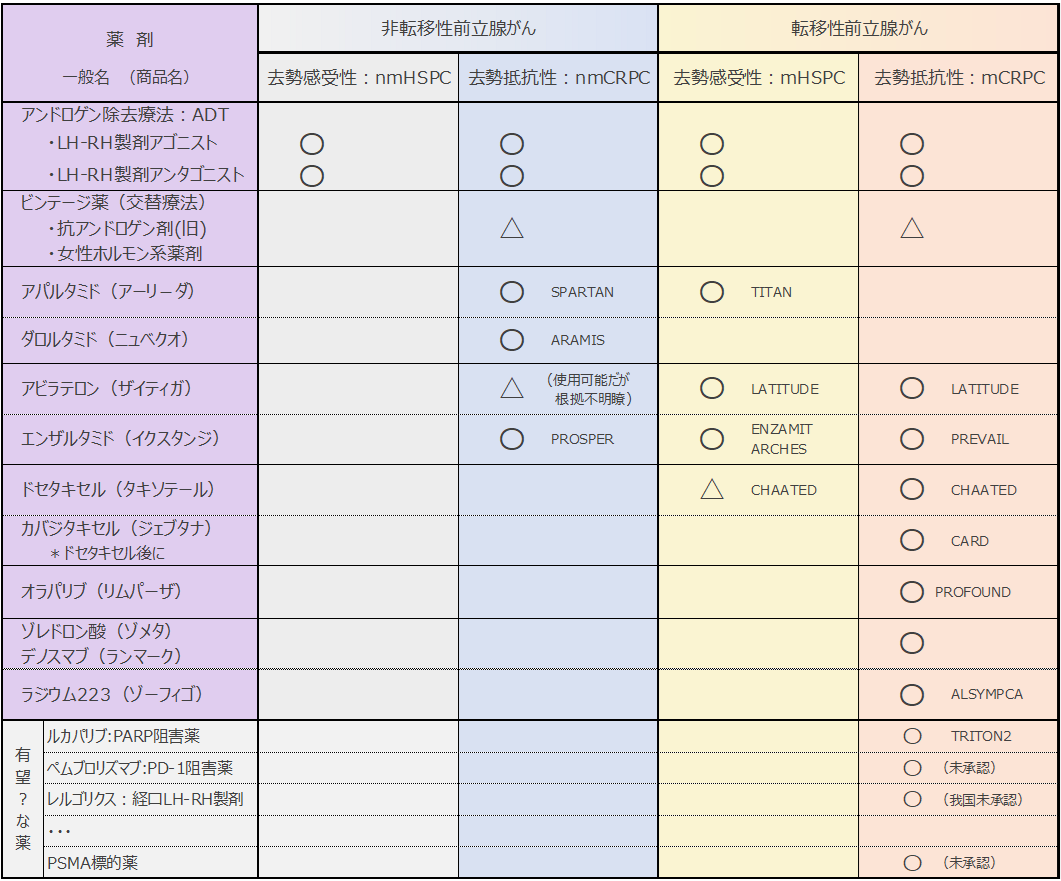
● 適応薬剤あれこれ
・非転移性 ホルモン感受性 前立腺がん:nmHSPC
・転移性 ホルモン感受性 前立腺がん : mHSPC
・非転移性 去勢抵抗性 前立腺がん :nmCRPC
・転移性 去勢抵抗性 前立腺がん : mCRPC
■ 骨転移について
● 緩和ケア(疼痛ケア・精神的ケア)
● 骨病変の治療薬
・ゾレドロン酸(ゾメタ)
・デノスマブ(ランマーク)
● 放射線緩和(延命)照射)
・緩和照射
・体内照射(ラジウム223)
● 脊椎の圧迫骨折・麻痺
■ 期待されるPSMA標的療法:早期承認を!
全身療法となる進行がん
転移がん
ここで言う転移がんというのは、リンパ節転移、骨転移、臓器転移がある前立腺がんで、TNM分類で言えば、N1M1、N1M0、N0M1 および病期T4の全て(D1,D2)がこれに含まれます。転移がんというのは、現在の医療レベルでは残念ながら完治は望み薄と言われており、標準的な治療法は、全身療法である薬物療法が中心となります。
前立腺がんの場合、限局がん、局所進行がんであれば、5年生存率は今やほぼ100%と言われていますが、転移がんでは67%(全がん協資料)とされており、やはり油断はなりません。
前立腺がんの5年生存率が良いのは、ほとんど治っているというわけではなく、再発も多いのですが、概ね進行が遅いため、5年程度では死亡に至らないだけであり、年数の経過と共に病状が進行し、非転移性のがんにも転移が出現したり、診断時から転移があった場合でも、ある時点から急速に転移が進行することも珍しくありません。
ただ、転移が見つかったというだけで「末期」と思って落ち込む必要はありません。
転移のある患者さんでも、長期間(10数年) がんと共存しながらQOL(生活の質)を維持しておられる方も少なからず居られるので、あきらめないことが肝要です。
診断でいきなり転移が見つかると、動揺してしまうと思うのですが、転移がんと言っても、その病状はさまざまであり、小さなリンパ節転移が数個程度のものから、通常の骨シンチでは骨が真っ黒に写るような「スーパースキャン」と呼ばれる超多発骨転移まで、様々な病状があります。
今、この転移はどのような状態にあるものなのか、まずは正確に知ることが必要となります。
骨関連事象(骨痛、神経圧迫、圧迫骨折等)に伴う痛みやQOLの悪化は、寿命にも影響を及ぼすと言われており、通常のがん治療と並行して、骨の健康を保ち、骨関連事象をしっかり予防する「骨マネージメント」が重要になってきます。
これは「骨転移について」を参照してください。
オリゴメタ(oligometastases:少数転移)
前立腺がんは骨に転移しやすいがんと言われています。
「リンパ節転移なら、まだ全身に広がっているとは言えないが、骨転移があれば、すでにがん細胞は血流に乗って全身に広がっており、局所治療は意味がない」
というのが以前からの考え方でした。しかし近年は
「たとえ微小ながん細胞が骨にたどり着いても、十分な環境が整うまではそこに休止状態で生着するだけであり、骨転移巣を形成するのはさほど簡単なことではなく、かなりの時間を要するらしい」
ということが分かってきました。
ならば、転移巣が少ない時に、それを叩いておけば、再度、転移巣が形成されるまでにかなりの時間が稼げるのでは、という仮定のもと、オリゴメタに対する放射線治療が行われるようになってきました。
大規模な比較試験はまだ数が限られていますが、施設ごとの報告では、かなり良好な結果が得られているようです。
少数転移(オリゴメタ)であれば、位置や個数にも寄りますが、放射線治療(多くは定位照射)で転移巣をうまく叩くことができれば、数年の延命効果は十分望める可能性があります。
そこそこ規模の大きい比較試験としては、STAMPEDE試験、HORRAD試験などがありますが、ORIOLE試験(第Ⅱ相ランダム試験)では、体幹部定位照射(SBRT)が全身性免疫反応も引き起こすことが示唆されています。
再発がん
外科的手術や放射線療法の後(ホルモン療法併用の有無は問わない)、PSAの上昇などにより再び前立腺がんの存在が検知された場合、それらを「PSA再発」もしくは「生化学的再発」と呼んでいます。PSA再発に関しては明確に統一された定義はありませんが、
PSAの上昇具合を観察しながら、一定の閾値(カットオフ値)を超えた場合に、「PSA再発」とみなされ、
その閾値は次のように決められています。
・全摘手術の場合 : 0.2
・放射線治療の場合: 最低値(nadir)+ 2.0
「PSA再発」と認定されても、この時点ではまだ症状もなく、転移等の病変も見つからないことがほとんどです。
「PSA再発」の後、画像検査で、転移巣や新たな病変が確認された時点で「臨床的再発」ということになりますが、これに至るまでの期間はさまざまで正確なデータはありませんが、周辺の患者さんでは2~5年程度が多いと思われます。
転移の判定は画像検査によるわけですが、近年、その画像検査が著しく進歩しつつあります。
FDG-PETや全身MRI(DWIBS)、さらにはPSMA-PET(未承認)などの高度な画像検査を行うと、従来発見できなかった「転移」が見つかるケースが多くあります。そういう意味では「PSA再発」と「臨床的再発」には、実際はさほど大きな違いがないのかもしれません。
画像検査の進歩というのは、存在が見えなかった転移が見えてくるというだけなので、病状の進行を心配するというよりも、それによって打つ手が出てくることを喜ぶべきでしょう。相手が見えないと、全身療法である薬物療法に頼らざるを得ませんが、相手の状況が分かると、他の治療法が見えてくるかもしれないからです・・・彼を知り 己を知れば 百戦殆うからず。
「PSA再発」と言ってもすぐに生命の危険に結びつくわけではありませんが、リスクの高い再発として用心すべきなのは、PSAの上昇スピードが速い時で、PSA倍加時間(ダブリングタイム)の目安が10か月以下の時であり(6ヶ月以下という説も)、PSAの上昇幅が年間2.0を超えるのも危険だと言われています。こうした場合には、将来遠隔転移が出現する可能性が高いと思ったほうが良さそうです。
手術後の再発
手術後、再発とみなされるのは次のようなケースです。
・PSAが下がり切らなかった場合(普通なら0.01以下になるはず)
・一旦下がった後にPSAが再び上昇し0.2を超えた場合
手術時に採取した標本が断端陽性を示した場合には、多くの場合、がん細胞を完全に取り切れていないことを意味しますが、経過観察を続けてもPSAがさほど上昇せず、一定の値で安定することも珍しくないので、これがそのまま再発に結びつくと考える必要はありませんが、それなりに慎重な対応が必要だと思われます。
局所再発と思われる場合には、救済放射線療法が可能ですが、
遠隔転移と思われる場合には、全身療法(薬物療法)でがんと共存する以外に方法はありません。
ただ、普通の画像検査では微小転移の有無までは分からないので、局所再発か遠隔転移かの判断は難しく、以下のような病状が重なると転移の可能性が高いと想定することが多いようです。
・PSA倍加時間(ダブリングタイム)が6ヵ月以下
・術後PSA再発までの期間が2年以内
・グリソンスコアが8以上
放射線療法は近年目覚ましい進歩を遂げており、狙った部分に集中的に高線量を照射することができるようになりましたが、
この恩恵に授かれるのは、放射線治療を初回治療として選んだ場合に限られます。
手術では、前立腺そのものは摘出済なので、前立腺床の近傍にがん細胞が残っている状態に対しては、高精度高線量照射を行うことはできません。周辺の健全な組織を狙わざるを得ないので、それを保護しようと思えば、やや広範囲に低目の線量を照射することになります。
それでも、微小ながん細胞を死滅させることは可能ですが、高精度照射に比べれば、線量が低いだけに効果も劣り、照射範囲も広いので、副作用も大きくなりがちです。
術後の救済放射線治療では、すでに照射範囲外に微小転移が散らばっている確率も高くなるので、約半数の患者は(施設によってデータは異なります)、5年以内に再度PSAの上昇に見舞われると言われています。
しかし、見方を変えれば、約半数は完治の可能性があるということなので、患者は当然、これにチャレンジするかどうかを判断する権利を有しているはずですが、こうした選択肢があるということを一切患者に示さない医師も珍しくありません。どういうおつもりなのか、訊いてみたいところですが。訊けば結局「局所再発ではないと判断した」という答えが返ってくるかもしれませんが、それは神様にしか分からないことであり、ことによると助かる患者を見殺しにしている場合があるかもしれません。
お若い人は特に、術後再発と言えば薬物療法だけではなく、救済放射線療法という選択肢もあるということをぜひ知っておいていただきたいと思います。
しかし、救済放射線療法は必ずしも楽観的なものではありません。
・成功する場合もあれば、無意味に終わる恐れもある。
・通常の救済照射では、施設による技量差が出にくい。
・副作用の増大により(治療が重なれば、副作用も足し算となります)、
なんらかの形でQOL(生活の質)に問題を生じる可能性がある。
このような点を総合的に判断し、今一度救済放射線治療に賭けるべきか、ホルモン療法を継続しがんとの共存を図るのか、いずれかの決断をすべきでしょう。ただ、もし救済照射後に再発したとしても、治療後ホルモン療法から解放された期間が何年かあったなら、それだけ去勢抵抗性となるまでの時間を延長できたという見方もできると思います。
放射線治療後の再発
放射線治療後にPSAが急に上昇し、またいつのまにか自然に下がる場合があります。これはバウンス現象と呼ばれていますが、なぜこうなるのか、詳しい理由はわかっていません。
小線源療法では約4割の患者にこの傾向が見られるので決して珍しいものではなく、外部照射でも2~3割の患者に見られるので、放射線治療の後にPSAが上がったと言っても、急に慌てる必要はありません。
まずは落ち着いてしばらく観察してみることが必要でしょう。多くの場合、またPSAが落ち着いてくれるはずです。
患者さんのご相談に乗っていると、しばしばPSA変動の記録を見せていただくことがあるのですが、PSAバウンスか再発かなんとも微妙な時期に早々とホルモン療法に切り替える例を散見します。放射線治療が失敗であるかどうかは患者にとっては重大なことなので、先生方にはこの見極めは極めて慎重にお願いしたいと思いますし、患者自身も、このPDSAの上昇は、バウンス現象ではないのかという意識を常に持っておくことが必要でしょう。
しばらく観察しても、やはりPSA値が上昇を続け再発が疑われる場合、まず考えられるのは、始めから前立腺の外部に「微小転移」があったことです。このような微小ながん細胞の存在は、現在の画像診断技術では、残念ながら検知のしようがありません。
がん細胞を完全に死滅できるだけの照射線量が不足していた場合や、なんらかの事情で、病巣全体をカバーしきれていなかった場合には、局所再発の可能性も考えられますが、近年は照射技術の向上に伴い、こうしたケースはずいぶん減ってきました。
放射線治療後の救済(サルベージ)療法としては次のようなものが考えられます。
・救済手術
照射跡には癒着が生じやすいので手術が難しく、合併症の程度も酷くなる可能性が高いので、放射線治療後の救済手術は不可能ではありませんが、日本での実施例はさほど多くはありません。
・救済小線源療法
放射線治療後の再発に対して、局所再発が強く疑われる場合には、小線源による救済療法が試みられることがあります。
局所再発と認定するためには、再度生検による確認も必要となりますが、それでも断定はできないので、そのあたりの判断はなかなか難しいといえましょう。
放射線治療を再度重ねることは、一般的にできないと言われていますが、
前立腺の内部に限定できるなら、それも可能となるわけです。
まだ、我国の実例はさほど多くはありませんが、海外ではかなりの実績があり、
我国でも、実施医療機関は限られますが、いくつかの実例が学会で発表されています。
・救済HIFE(高密度焦点超音波療法): 非保険適用
内容は「フォーカルセラピー(第3章)」を参照願います
・救済凍結療法(クライオセラピー): 非保険適用
内容は「フォーカルセラピー(第3章)」を参照願います
・薬物療法
放射線治療後に再燃した前立腺がんに対しては、通常内分泌療法が適用されます。
内分泌療法は全身療法でもあるので、前立腺がんがどこにあってもその成長を抑えられることがメリットであり、通常、内分泌療法で一定期間はがん細胞の抑制が可能となります。
しかし、ほとんどの場合、ある時点以降再び成長を始め、コントロールが効かなくなってしまいます(去勢抵抗性前立腺がん:CRPC)。
救済治療に賭けるのか、薬物療法に甘んじるのかは、年齢(期待余命)、健康状態も含めてじっくり考える必要がありそうです。
薬物療法
前立腺がんと男性ホルモン
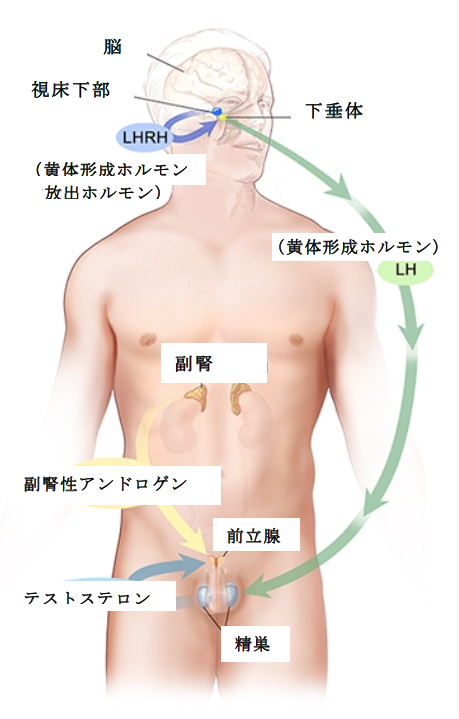
前立腺がん細胞は男性ホルモン(アンドロゲン)に依存して増殖するのが一般的です。
視床下部より分泌されたLH-RH(黄体形成ホルモン放出ホルモン)により刺激を受けた下垂体は、LH(黄体形成ホルモン)の分泌を促し、LHは精巣内の特定の細胞に作用し、テストステロンの産生を促します。
男性ホルモン(アンドロゲン)の主なものはテストステロンで、その大部分(95%)は精巣で作られ、副腎でも少量(5%)が作られています。またごく少量のテストステロンが、前立腺がん細胞内でも作られていることが分かってきました。
増殖しつつある前立腺がんでは、特に多量の男性ホルモンを必要としますが、
・精巣で産生される男性ホルモンを抑制する
・男性ホルモンが前立腺に達する経路を断つ
などの方法により、前立腺がんの増殖を抑えることが可能であり、こうした治療法を内分泌療法(ホルモン療法)と呼んでいます。
また内分泌療法に反応する状態のことを、アンドロゲン依存性(感受性)があると言います。
ほとんどの前立腺がんは内分泌療法によく反応しますが、まれに、初めからこの治療法が効かない悪性のがんもあります。
前立腺がん細胞の種類で一般的なのは「腺がん」であり、初期には特に内分泌療法によく反応しますが、時間の経過と共に感受性が薄れ、やがて去勢抵抗性がんとなってしまいます。
前立腺がんでは珍しい細胞種(小細胞がんや扁平上皮がんなど)ではアンドロゲン依存性が乏しく、早々に抗がん剤など他の治療オプションを探らねばなりません。
特に小細胞がんは、新規のホルモン療法も効きにくく、ともかく進行が早いので、油断がなりません。
外科的去勢と内科的去勢
精巣を摘出するとテストステロンが作られなくなり、前立腺がんの有力な治療法になることを発見したのはシカゴ大のハギンス博士で、半世紀以上前にノーベル医学・生理学賞を受賞されています。
精巣摘出術は、その後、長期に渡って行われて来ており、これを外科的去勢と称しています。
しかし、現在は、これと同等の働きをする薬が使われるようになってきました。
LH-RH製剤(アゴニストおよびアンタゴニスト)ですが、こちらは前者の外科的去勢に対し、内科的去勢と呼ばれており、これらの去勢全体をアンドロゲン除去療法(ADT)と称しています。
アンドロゲン除去療法(ADT)を行うと、精巣経由のテストステロンを遮断できるので、血中テストステロン濃度を大幅に(95%)減少させることが可能ですが、副腎などで産生される男性ホルモン(5%)までは止めることはできません。さらに去勢の効果も永続的とは言えず、治療を継続している内に、やがていつか去勢抵抗性前立腺がん(CRPC)となってしまうのは、外科的去勢でも内科的去勢でも同じことです。
外科的去勢は男性ホルモンの枯渇に伴う副作用のみですが、内科的去勢は薬剤そのものの副作用も加わります。外科的去勢では、失った性機能を元の状態に戻すことはできませんが、内科的去勢は可逆性があります。ただし、服薬期間が長いほど状態が戻る時間も長くかかります。コスト面では外科的去勢のほうが有利になります。精巣摘除術では、通常、一月分の高額療養費限度額で済むのですが、内科的去勢では毎月数万円以上の支払いが、長期に渡って発生します。
外科的去勢は、このところあまり行われなくなってきましたが、事情によっては外科的去勢のほうが有利な場合もあります。
・ 薬剤の副作用がきつい
・ 費用負担がきつい
・ 老齢で通院がしにくい など
精巣の摘出は、陰嚢の中央縦線に沿って切開し、両側の精巣(睾丸)を摘出後、切開部を縫い合わせるので、外見上はさほど大きな違和感はありません。また、精巣全体ではなく、アンドロゲンを産生する精巣内の組織のみを摘出する「被膜下精巣摘除術」という方法もあります。
去勢抵抗性前立腺がん:CRPC
男性ホルモンに依存性であった前立腺がんも、その大部分を占める精巣由来のテストステロンが枯渇すれば、副腎経由や前立腺がん細胞自身が産生するわずかなアンドロゲンだけでも生き延びられるよう、徐々に自らの性質を変え、非依存性を強めて行きます。
このため、アンドロゲン除去療法(ADT)を継続するわけですが、やがてはなお生き延びていけるだけの強力な「去勢抵抗性」を獲得してしまいます。日本では、これに抗アンドロゲン剤(多くはビカルタミド)を加え、より強力にアンドロゲンを遮断するCAB療法が多く用いられていますが、それでもやはりいつかは去勢抵抗性前立腺がん(CRPC)となってしまいます。
ADTとCABで、結局のところどちらが優位なのかはわかっておらず、CABは世界的に見れば異端な治療法であり、日本独自と言っても過言ではないので、この解説では特に断らない限り、さほど厳密には区別しておりません。
男性性ホルモンが体内から奪われた、いわゆる去勢状態(テストステロン濃度が50ng/dl以下、かつPSAが2以下)であるにも関わらず、前立腺がんが再び勢いを盛り返し成長を始めた場合、すでに治療中の薬剤に対する耐性を獲得してしまったことを意味し、この状態を、かつては「再燃がん」とか「ホルモン抵抗性がん」と称していましたが、現在は「去勢抵抗性前立腺がん:CRPC」と呼ぶようになりました。
CRPCになると、しばしば急速に病勢が進行し、非常にやっかいな相手となってしまいます。
古くは、CRPCになると数年程度しか生きられないと言われていましたが、現在は薬剤も増え、従来よりもっと余裕があると考えられるようになってきました。
2014年以降、CRPCに対する持ち駒が一挙に増え、薬物療法の「パラダイムシフト」と言っても過言ではない状態に突入したのですが、注意をしなければならないのは、すべての薬剤が使える(効果がある)とは限らないということと、一定の副作用は必ずついて廻るということです。
CRPCという病態は、治癒の見込みはほとんどなく、いかに長くがんと共生できるかがポイントとなってきますが、患者もこれには目を逸らさず、はっきり自覚しておく必要があるでしょう。がんと共に残りの人生をどのように生きたいのか、そのためにはどのような治療法を受けるべきか、医師と患者で食い違いの生じないようしっかり意思疎通を図っておくべきでしょう。
医師は、これまでの治療経歴はもちろんのこと、患者固有のあらゆる条件(社会的環境や人生観など)への配慮が必要となりますし、
患者自信もはっきりと自分の希望を告げ、目指すゴールが同じであることを確認しておくべきと思われます。
薬物療法の種類
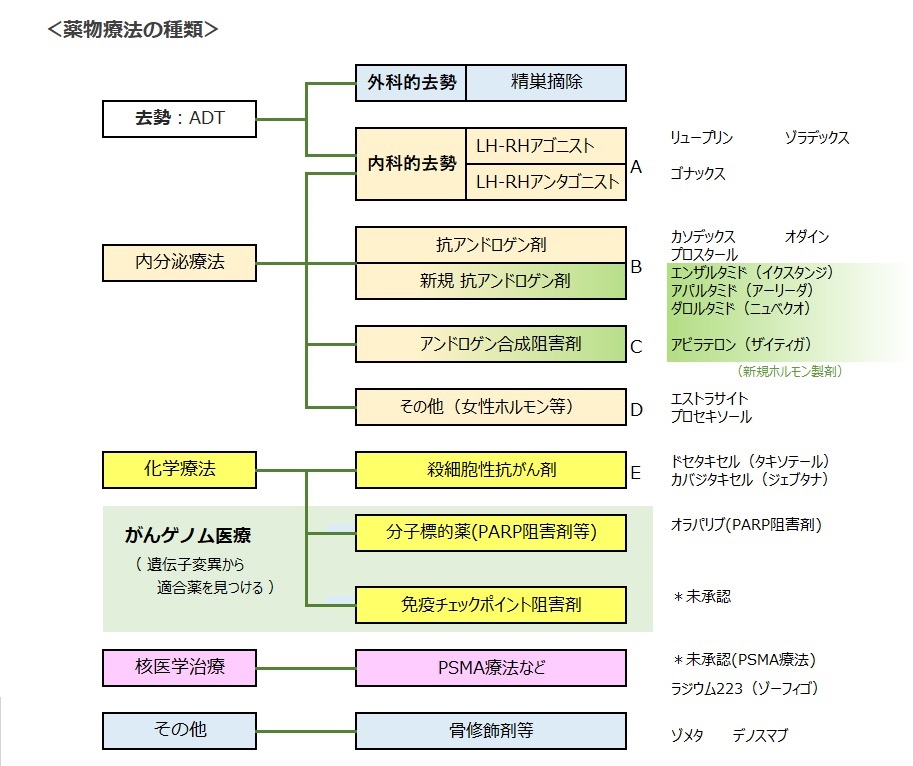
薬物療法というのは、次のような薬剤を用いた全身療法のことです。
1) 内分泌療法(ホルモン療法)
・ LH-RH製剤(アゴニスト・アンタゴニスト):アンドロゲン除去療法(ADT)
・ 抗アンドロゲン剤(新・旧)
・ アンドロゲン合成阻害剤
・ 旧来からのいわゆるヴィンテージ薬
*抗アンドロゲン剤(新)とアンドロゲン合成阻害剤は、新規ホルモン薬と呼ばれている。
2) 化学療法(抗がん剤)
・ 殺細胞性(従来型)抗がん剤 ・・・ドセタキセル、カバジタキセル
・ 分子標的薬(PARP阻害剤等)・・・未承認
・ 免疫チェックポイント阻害剤 ・・・未承認
3) 核医学治療(放射性医薬品)
・ PSMA標的療法・・・未承認
4) その他、骨修飾剤等
・ ビスフォスホネート(ゾレドロン酸:ゾメタ等)
・ ラジウム223
内分泌療法(ホルモン療法)
内分泌療法は、主に次のような場合に用いられます。
・ 手術や放射線治療で根治が望めない進行がんに対して。
・ 高齢ゆえ必ずしも治癒を狙う必要がなく、がんとの共存を目ざす場合。
・ 放射線治療と併用し、治療成績の向上をはかる場合。
・ 根治狙いの治療後に再発した場合。
内分泌療法の一般的な副作用は、こんなところです。
・ 性欲減退
・ 勃起不全
・ ほてり、発汗
・ 骨密度低下
・ 骨折
・ 筋肉量の減少と体力低下
・ 血中脂質の変化
・ インスリン抵抗性
・ 体重増加
・ 気分変動
・ 疲労
・ 乳房組織の肥大(女性化乳房)
患者の副作用の訴えには、バネ指などの末梢神経障害の報告も多いようですが、これは「ホルモン療法の副作用ではない」という医師も珍しくないので、患者の感覚とはかなり開きがあるようです。
内分泌療法が長期に渡ると、筋力の低下や骨粗しょう症の恐れも生じるので、骨密度の管理にも注意が必要となってきます。近年は、鬱、集中力、記憶力など認知機能に関わる障害も問題点として取り上げられるようになってきました。米国泌尿器科学会(AUA2019)の報告では、ADTを7か月以上受けた患者では、アルツハイマーのリスクが41%高くなるようですが、まだこれについては医師の関心は高くないかもしれません。
内分泌療法は、数年から10年程度で耐性が生じ、効果が薄れるのが一般的です。アンドロゲン依存性のがん細胞がアンドロゲン非依存性に変わるためと言われていますが、去勢状態であるにもかかわらず、PSAが上昇し、ホルモン療法の効果が見られなくなってしまった状態を「去勢抵抗性前立腺がん」(CRPC)と呼んでいます。
ちなみに、内分泌療法に感受性のある状態はHSPC(Hormone-Sensitive Prostate Cancer)またはCSPC(Castration-Sensitive Prostate Cancer)と略称しています。
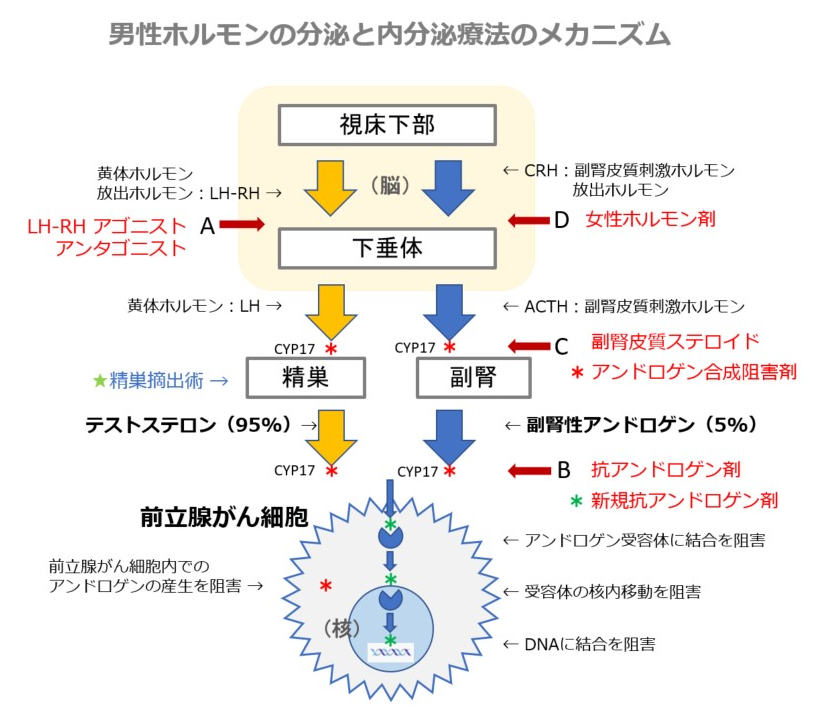
上図の黄矢印は、精巣でのアンドロゲン産生を促す経路であり、これを抑制する治療法はアンドロゲン除去療法(ADT:Androgen Deprivation Therapy)と呼ばれ、前立腺がんに対して最も基本となるホルモン療法で、多くの前立腺がん患者が最初に受けるホルモン療法です。日本ではこれに抗アンドロゲン剤(最も良く用いられるのはカソデックス)を加えたCAB療法が、ファーストラインの治療法としてほぼ標準となっています。
抗アンドロゲン剤は、アンドロゲン除去療法(ADT)では抑制できない青矢印の経路も阻害するものですが、新規ホルモン剤(アンドロゲン合成阻害剤を含む)は、それぞれ複数の段階で効果を発揮するので、強力な抑制効果を得ることができます。
新規ホルモン剤は、当初は去勢抵抗性前立腺がんに対する薬という位置づけでしたが、現在は、アビラテロンに続いてエンザルタミドも、遠隔転移のあるがん(正確にはハイリスクの予後因子の該当条件を満たすがん)であれば、ホルモン感受性前立腺がん(HSPC)であっても、ファーストラインで使っても良いということになっています。
これまで去勢抵抗性がんで使われてたこのような薬を、早期からファーストラインで用いるこのような方法を、最近は「アップフロント療法」と称しており、欧米では、ドセタキセル(抗がん剤)もこの位置づけになっています。「リスクの高い症例に対しては、早期に効果の大きい薬を使う」という考え方が、ここ数年の間に急速に広まりつつあります。
LH-RH製剤(ADT):A
LH-RHアゴニスト(作動薬)
LH-RH(黄体形成ホルモン放出ホルモン)アゴニストは、生体のLH-RHと構造が類似している合成タンパク質で、下垂体のLH-RH受容体に結合し、最終的にLH(黄体形成ホルモン)の分泌を抑制します。LH-RHアナログとか、GnRH(ゴナドトロピン放出ホルモン)アゴニストとも呼ばれています。
通常、体内のアンドロゲン濃度が低いときは、LH-RHが下垂体を刺激してLH(黄体形成ホルモン)が放出され、LHは精巣でのアンドロゲン産生を促します。LH-RHアゴニストも同様にLHの産生を促しますが、LH-RHアゴニストの高レベル状態が続くと、その信号を受けた下垂体は反応を停止しLHを作らなくなります。その結果、精巣もLHの刺激を受けなくなり、アンドロゲンの産生が停止します。スピードが出過ぎると自動的に装置が働いて列車を停めるATSと似ていますが、一旦スピードをあげてから、間接的にブレーキをかけるため、制御が働くまでのタイムラグが問題になることがあります。
LH-RH(黄体ホルモン放出ホルモン)アナログの投与後数日間は、LHの分泌を刺激し続けるので、一時的にテストステロンが増大します。 このため、病状の亢進(骨痛、排尿困難、脊髄圧迫など)いう逆効果が見られることがあるので、進行前立腺がんにおいては特に注意が必要です。これをフレアアップ(燃え上り)現象と言いますが、こうした逆効果を押さえるために、 抗アンドロゲン剤(ビカルタミド等)を先行投与することが多くなっています。
わが国でLH-RHアゴニストに該当するのは、リュープリン(リュープロライド)と ゾラデックス(ゴセレリン)です。これらはいずれも成分が徐々に放出されるよう用に工夫された徐放剤で、その効果は長期に渡って持続が可能で、1ヶ月用の他、3ヶ月用、6ヶ月用(これはリュープリンのみ)があります。
へそ周辺等の皮下脂肪層へ注射するのが標準となっており、リュープリンは普通の液体注射ですが、ゾラデックスは半固形物の埋込注射となります。
注射後が赤くはれ、痛みとかゆみを伴うことが良くあります。
LH-RHアンタゴニスト(拮抗薬)
LH-RHアンタゴニスト(GnRHアンタゴニストとも称される)は、LH-RHが下垂体のLH-RH受容体と結合するのを阻害することにより、下垂体からのLH(黄体形成ホルモン)の放出を抑制し、精巣によるアンドロゲン産生を抑制します。LH-RHアンタゴニストはLH-RHアゴニストと異なり、作用機序が直接的で、体内のアンドロゲン濃度をすみやかに低下させるので、フレアアップ現象は生じません。
デガレリクス(ゴナックス)がこれに該当し、2012年6月に承認されました。これも皮下注射ですが、初回は腹部2か所に120mgずつ、その後は80mgを4週ごとに投与する必要があります。
アンドロゲン除去療法(ADT)に用いる薬剤には、LH-RHアゴニストであるリュープリン、ゾラデックスとLH-RHアンタゴニストであるゴナックスがありますが、これらはどれを用いれば良いのでしょうか。患者の声を多く聞く機会があるので、それらに基づく見解を述べておきます。
注射時に痛いのはゾラデックス。半固形物の埋込なので注射針が太いためと思われます。注射部位の纐纈(こうけつ)や腫れ、痛みやかゆみは上記のいずれにもあり、あるていど覚悟が必要ですが、腫れや痛みが最も強いのはおそらくゴナックスでしょう。ただ、ゴナックスはPSAの抑制が俊敏なので、PSAがハイリスク(20以上)の場合や、浸潤、転移があるような進行がんにおいては、これを使ったほうが良いかもしれません。心血管の既往症のある人にはゴナックスのほうが良いというデータもあるようです。
これらのLH-RH製剤はすべて注射薬(徐放剤)ですが、近い将来、LH-RHアンタゴニストの錠剤(レルゴリクス)が保険適用となりそうです。第Ⅲ層治験で治療成績、副作用とも良好な結果が出ており、すでにFDA(米食品医薬品局)では承認申請を受諾しています。
抗アンドロゲン剤:B
抗アンドロゲン剤は、アンドロゲン(男性ホルモン)がその受容体と結合するのを妨げ、アンドロゲンの作用を抑制するが、アンドロゲンの産生そのものは阻害しないため、体内には男性ホルモンが存在しており、前立腺の手前でブロックをしている状態なので、性機能のダメージは少ないと言えます。
ただし、抗アンドロゲン剤単独では、その効果は限定的なので、多くの場合、アンドロゲン除去療法(ADT)を併用します。
アンドロゲンの大部分(95%)の抑制をADTで行いながら、残る5%の抑制を抗アンドロゲン剤にゆだねるやりかたが日本では標準的で、できるだけ完全に男性ホルモンを抑制するこのようなやり方をCAB療法(Complete Androgen Blockade)と呼んでいます。MAB療法(maximam androgen blockade)という言い方もありますが、あまり言われなくなって来ました。
従来から使われている抗アンドロゲン剤は数種類ありますが、まずは、比較的副作用の少ない非ステロイド性のビカルタミド(カソデックス)を用いることが多く、その効果が無くなって来た時に、非ステロイド性のフルタミド(オダイン)に切り替えると、再び効果が表れることがあり、これを抗アンドロゲン剤交替療法と称しています。
また、交代療法を行う前に、ビカルタミドを止めた時点で様子を見てみると、それだけでPSAが下がる場合もあり、抗アンドロゲン剤除去症候群(AWS)と称しています。
プロスタール(ステロイド性)という薬剤もありますが、アンドロゲン以外のホルモンにも作用する
恐れがあるのでやや副作用がきつく、現在はあまり使われておりません。
ただ、近年はこうした古い抗アンドロゲン剤は、始めの1種類に留め、効果がなくなった時点で、すぐ新薬に移行することが増えてきました。
そうした新規ホルモン療法薬のひとつが、2014年に去勢抵抗性前立腺がん(CRPC)を対象に承認されたエンザルタミド(イクスタンジ)で、これも抗アンドロゲン剤に分類されます。現在はCRPCに限らず様々な場面で用いられるようになっており、アンドロゲンが受容体と結合する過程のみならず、前立腺がん細胞の核内へ移行する過程や、核内でDNAと結合する過程を阻害するなど、3つの段階で強力にアンドロゲンを阻害することが知られています。
海外で実施された第Ⅲ相臨床試験(AFFIRM試験)では、全生存期間(OS)の中央値が4.8か月延長されています。
アンドロゲン合成阻害剤:C
アンドロゲンは精巣でその大部分が作られていますが、少量は副腎や前立腺がん細胞自身でも作られています。
アンドロゲン合成阻害剤は、それら全てのアンドロゲン産生を抑制する薬剤です。男性の体内において、コレステロールからテストステロンを産生する際には、精巣、副腎、および前立腺がんの組織内に存在するCYP17という酵素が重要な役割を果たしており、経口薬剤であるアビラテロン(ザイティガ)はCYP17を阻害することでテストステロンの産生を抑制します。
アビラテロンは2014年に転移性去勢抵抗性前立腺がん(mCRPC)に対する薬として承認され、従来の薬剤と比べて、体内のテストステロン濃度を大幅に低下させることが可能と言われていましたが、現在では転移性去勢抵抗性前立腺がん(mCRPC)のみならず、転移性のホルモン感受性がん(mHSPC)に対しても用いられるようになり、基本的な内分泌療法と共に初期から用いられる事例も増えてきました。
この薬は、食物とともに摂取すると効果に大きなばらつきが生じるので、空腹時(食事の1時間以上前、2時間以上後)に飲むことを、できるだけ厳格に守る必要があります。
副作用の主なものは、心障害、肝機能障害、低カリウム血症などと言われています。
アビラテロンはプレドニゾンとの併用で用いる必要がありますが、時に表現の簡略化のためプレドニゾンが省かれる場合もあります。しかし実際は、アビラテロンと言えば常にプレドニゾンとワンセットで用いられるという解釈をしてください。
米国では他にも同類の薬がありますが(ケトコナゾール、アミノグルテチミド)、日本で、アンドロゲン合成阻害剤と言えば、現在はこのアビラテロンただ一つになります。
その他、旧来の内分泌療法:D
従来から用いられていた効果の薄い薬剤は、徐々に使われなくなってきましたが、
薬を変えながら、トータルとして薬剤に抵抗性が生じる期間を長引かせることも可能では、という考え方もあります。非転移性の去勢抵抗性がん(nmCRPC)で、PSAの上昇速度が比較的遅いような場合には、新薬や抗がん剤の使用を急がなくとも、従来から使われている薬を変えながら、時間稼ぎをしても良いのではという考え方です。
新薬が優れているというエビデンスは、1対1の比較によるものは多いのですが、複数の薬剤を順次取り替えた場合との比較というのはほとんどありませんが、「抗アンドロゲン薬の交代療法は、新薬の早期治療に劣らない」という報告(大阪市大 泌尿器科 井口講師)もあるので、薬が「古い」という一言で除外する必要はなさそうです。
従来からのヴィンテージ薬で、今もしばいしば使われるのは女性ホルモン系の薬です。
・エストラムスチン(エストラサイト): 女性ホルモン剤と抗がん剤(ナイトロジェン
マスタード)から成る薬です。
・プロセキソール:
いずれも、おどろくほどの効果を示す場合があります。欧米では心血管障害が出やすいということで、現在はほとんど使われていませんが、心血管障害の発生率は、欧米と日本ではかなりの開きがあり、その程度のリスクをこの薬のベネフィットと比較すれば、治療選択肢から一律に除外する必要はなさそうに思われます。
価格の点からも、患者にとっては、これらはありがたい薬と言えるでしょう。
化学療法
前立腺がんで用いられるのは、ドセタキセルやカバジタキセルなど、従来から用いられている殺細胞性(細胞障害性)抗がん剤ですが、近年は、がん種別にそのような抗がん剤を使い分けていた時代から、がん種にとらわれず、個々の遺伝子変異に応じて分子標的薬や免疫チェックポイントポイント阻害剤を使う個別医療の時代へと流れが変わろうとしています。
令和と共に始まったがんゲノム医療ですが、その先端を走っているのは肺がん分野であり、大腸がん、乳がんなどがそのあとを追いかける形で、日々研究が進みつつあります。
前立腺がんでは、これまで遺伝子変異に適合する薬剤がなかったこともあり、がんゲノム医療についてはかなり後れを取っており、遺伝子変異の調査も、実際の診療で行われることはほとんどなかったのですが、ここにきて、前立腺癌がんに効果のある分子標的薬や免疫チェックポイント阻害薬が、近い将来、承認される可能性が高まっており、これらが承認されれば、一気に前立腺がん分野でも、ゲノム医療の時代を迎えるのではないでしょうか。
特定の遺伝子変異にターゲットを定めた抗がん剤は、理論上は殺細胞性抗がん剤より副作用は小さくなると言われており(必ずしもそうとは限らないようですが)、今後は、抗がん剤に対する患者の抵抗感も少しは薄らぐかもしれません。
抗がん剤治療も、いよいよ新し時代を迎えようとしています。
今後、期待される抗がん剤ということで、分子標的薬、免疫チェックポイント阻害薬の候補をそれぞれ以下の項であげておきます。
従来型(殺細胞性)抗がん剤
ほんの10数年前まで、「前立腺がんに抗がん剤は効かない」と言われていましたが、2008年にドセタキセル(タキソテール)が、わが国で承認されてから、ドセタキセルはいわば「最後の砦」という形で使われてきました。
2014年に、新規ホルモン製剤と共にカバジタキセル(ジェブタナ)が承認され、「最後の砦」をこれに譲ったわけですが、これらはいずれもタキサン系と言われる従来型の(殺細胞性または細胞障害性)抗がん剤です。
前立腺がん患者には高齢者が多いこともあり、「できれば避けたいし、やむを得ず使うなら後に回したい」という患者が多いようです。
ドセタキセルの投与法については、かなりバラつきがあるようです。3~4週ごとに60~70mg/㎡が多いようですが、2週ごとに半量の投与に変えると副作用が減るという報告も一部にあります。
前立腺がん診療ガイドライン2016には、ドセタキセルの投与法について、このように記されています。「ドセタキセルの至適投与量・投与間隔については,併用薬剤や,患者の年齢や状態,副作用の発現状況などによって個別に決定すべき・・・」
2014年の米国臨床腫瘍学会(ASCO)では「転移の多い進行がんでは、従来のホルモン療法にドセタキセルを併用すれば、大きく生存期間(OS)が伸びた」という発表があり、注目を集めました。
わが国では、ドセタキセルが使えるのは有転移去勢抵抗性前立腺がんに限られるので、このような使い方はできませんが、海外では、ハイボリュームの転移がある場合は、早期からドセタキセルを用いることが標準治療の一つとなっています。
分子標的薬(未承認)
FDA(米国食品医薬品局)は、2020年5月、新規ホルモン療法薬とタキサン系抗がん剤(ドセタキセル、カバジタキセル)をやり終えた患者で、BRCA変異を伴うmCRPC患者を対象とする経口剤ルカパリブを迅速承認しました。
FDAはまた、HRRm(相同組換え修復関連遺伝子変異)を有し、新規ホルモン製剤の効果がなくなったmCRPC患者を対象とするPARP阻害剤オラパリブ(リムパーザ)の追加承認申請を2020年1月に受理しているので、いずれ遠くないうちに日本でも承認されるのではないでしょうか。
これらの薬はすでに、卵巣がんや乳がんで注目されている薬ですが、共通の遺伝子変異があれば前立腺がんにも有効と考えられています。
免疫チェックポイント阻害剤(未承認)
本庶佑先生のノーベル賞で有名になった免疫チェックポイント阻害剤、抗PD-1抗体薬「ニボルマブ(オプジーボ)」もmCRPCの薬として治験中であり、期待もされていますが、より現実味を帯びているのは、同種の薬「ペムブロリズマブ(キイトルーダ)」ではないでしょうか。
がんゲノム医療の時代へ
令和の時代と共に始まったがんゲノム医療というのは、遺伝子情報に基づく個別医療の一つであり、肺がん、大腸がん、乳がんなど、遺伝子変異に基づく薬剤がたくさんあるがん種では、多数のがん遺伝子変異を同時に調べる「がん遺伝子パネル検査」が行われていますが、前立腺がんでは、ゲノム医療という言葉はほとんど聞いたことがありませんでした。
しかし、遺伝子変異と関連する薬剤が、まもなく前立腺がんでも使えるようになりそうです。こうなると、前立腺がんでも、いずれ近いうちにがんゲノム医療も実診療で取り上げられるはずです。
標準治療を終えてしまって、もう他に次の薬が見当たらないというような時には、遺伝子変異を調べて、適合薬を探すという方法が、いずれ前立腺がんでも普通になるのではないでしょうか。ただ、間際になって慌てても間に合わない可能性もあるので、このような予備知識は持っておくに越したことはありません。
適応薬剤あれこれ
非転移性 ホルモン感受性前立腺がん:nmHSPC
初診時に、限局がんあるいは局所進行がんと言われた、早期前立腺がん患者がこの分類に該当します。
中~高リスクの早期前立腺がん患者は、しばしば、放射線治療の前後(最中も)にアンドロゲン除去療法(ADT)を併用します。中リスクなら6カ月程度。高リスクでは18~30カ月ぐらいでしょうか。
外照射とアンドロゲン除去療法(ADT)を併用すれば、外照射のみの時と比べて、全生存期間と無再発生存期間が延長すると言われていますが、ADTの併用期間は確立されておらず、医療施設によって方針が異なります。
手術後(全摘除術後)にアンドロゲン除去療法(ADT)を受けることも、高リスクがんの場合にはたまにあります。手術後にADTを受けた患者は、手術のみの患者と比べて、全生存期間は延長しませんが、無再発生存期間は延長します。手術前のADTは特にベネフィットが無いので、ほとんど行われておりません。
こうした病態(nmHSPC)の場合は、アンドロゲン除去療法(ADT)が基本となります。海外ではLH-RH製剤単独の場合も多いのですが、日本ではこれにビカルタミド(カソデックス)を加えた「複合アンドロゲン除去療法(CAB療法)」が多く用いられています。
高齢者など、積極的な治療を望まない患者に対しても、アンドロゲン除去療法(ADT)を行うことがあります。
病状が安定しており、進行が緩い場合には、間歇的ホルモン療法を選択肢に入れても良いかもしれません。
転移性 ホルモン感受性前立腺がん:mHSPC
初診時に、転移性前立腺がんと告げられた患者も、やはりアンドロゲン除去療法(ADT)が基本となります。
かつては、ADTの効果が続くかぎり、この治療を継続し、効果が失せてきてから、セカンドラインの薬物療法に変わるのが普通でしたが、最近ではもっと早期から、強力な薬をADTと併用することが増えてきました。
化学療法剤ドセタキセルの投与を受けた患者は、ADTのみの患者と比べて、全生存期間が延長するという研究発表がありました。転移が少ないと大差はないが、転移量が大きいほどドセタキセル早期投与の益も大きくなるとか。(CHARTED試験)
その後、いくつかの新規ホルモン療法剤でも、ドセタキセル同様、早期からADTと併用すれば益のあることが分かってきました。
アビラテロン/プレドニゾン(LATITUDE試験)の他、最近になってエンザルタミド(ENZAMIT試験、ARCHES試験)、アパルタミド(TITAN試験)も、ADT単独療法と比べて、生存期間を延長することが示されています。
ごく最近(2020)適応拡大承認を受けた、エンザルタミドとアビラテロンは「転移がん」全般に使えるようになりましたが、先に(2018年)適応追加承認を受けているアビラテロンは以下の3つのハイリスク予後因子のうち、2つ以上を有する場合とされています。
1) Greason スコア≧8
2) 骨シンチで3ヶ所以上の骨病変あり
3) 内臓転移あり(リンパ節転移を除く)
内臓転移がハイリスクであることは自明なので、GS8以上 かつ 骨転移3以上と覚えておいても良いでしょう(ドセタキセルのCHAARTED試験では、GSの規定はなく骨転移4以上となっています)。
少数転移で比較的おとなしいがんであれば、従来通りアンドロゲン除去療法(ADT)を第一選択と考えて良いと思われますが、近年、世界的な動向としては、リスクが高いと思われる症例に対しては、早期から強力な治療を行うことが望ましいという認識になってきました。
本来、去勢抵抗性がんに対して用いられてきた薬を、早期から(ほぼ診断時から)使用するこのような方法には、すでに「アップフロント療法」という名称が付けられています。
現在、ダロルタミドは非転移性去勢抵抗性がん(nmCRPC)の薬として認可されていますが、これもアパルタミドの経過と同様、いずれ「アップフロント療法」の仲間入りをするのではないでしょうか。
骨修飾剤(骨転移に対する薬)は、骨転移に伴う様々な症状を(SRE)の発現を遅らせ、QOLを良好に保つのに有用と言われていますが、ホルモン感受性の患者に対して用いるべきかどうかは明確な答えはありません。私見ですが、アンドロゲン除去療法(ADT)が効いている間は、骨症状も抑えられることが多いので、骨修飾剤の使用は去勢抵抗性がん(CRPC)になってからでも良いのではないでしょうか。
ホルモン療法だけと比較して、それ以上の効果があるかどうかは不明であり、副作用のリスク(顎骨壊死、低カルシウム血症)も考えれば、おそらくこれが妥当だと思われますが、意見の異なる専門医もおられると思います。主治医と良く相談なさってください。
非転移性 去勢抵抗性前立腺がん:nmCRPC
初診時に画像上転移が見つからなかった早期前立腺がん患者が、初期治療後に生化学的再発を認め、アンドロゲン除去療法(ADT)を加療中に去勢抵抗性前立腺がん(CRPC)となったもの、もしくは一次治療としてアンドロゲン除去療法(ADT)を開始し、その後CRPCとなったものがこれに該当します。
一次ホルモン療法が効かなくなってきても、基本的にADTは継続します。少しでもアンドロゲンを抑えておきたいためです。
PSAの倍加時間(ダブリングタイム)が10ヶ月以下であれば、急速に病状が進行していると考えられるので、強力な新規ホルモン療法薬を加えることを考えます。
使える薬は、アパルタミド(SPARTAN試験)、ダロルタミド(ARAMIS試験)、エンザルタミド(PROSPER試験)となります。
去勢抵抗性前立腺がん(CRPC)となっても、転移が生じるまでの期間を延長できればそれに越したことがないわけですが、これらの薬は、中間解析において、いずれも無転移生存期間(MFS)の中央値を延長することが確認されています。その後、2020年9月現在、最終解析において、共に全生存期間(OS)を優位に延長することが認められました。
nmCRPCに対して、試験結果として明確な裏付けがあるのは、この3剤ですが、これより先に認可された(転移、非転移の区別が明確に意識されていない時に)アビラテロンも、保険適用という意味では使えるようになっています。
使用順序はどれが望ましいか気になるところですが、定説はありません。
あえて意見を言わせていただくなら、現時点ではダロルタミドだけが転移性CRPCでは使えないので、この段階で使っておいた方が、トータルとして使える薬剤が増えるので、有利と言えるかもしれません。
また、ダロルタミドの特徴として副作用の発生頻度が少ないということもあります。
PSAの倍加時間(ダブリングタイム)が10ヶ月以上であれば、病状の進行が比較的緩いと考えられるので、いましばらくこれまでの治療を継続するか、従来から使われている、いわゆるヴィンテージ薬を使用しても良いかもしれません。
(10ヶ月丁度ならどうするかというのは愚問です。医学は数学ではありませんので、そのあたりは適当に、様々な条件を加味しつつ判断すればよいわけです。)
ビカルタミド(カソデックス)をフルタミド(オダイン)に変えてみるとか、
女性ホルモン系の薬を使ってみても良いのではないでしょうか。
ただし、近年、特にお若い先生は、これらの薬の使用経験が少なく、欧米では使すでにわれていない薬なので、このようなオプションを否定される可能性もあります。
ヴィンテージ薬を使うかどうかは、医師によって考え方が大きく違うと思われます。
また、転移がないという診断であっても、画像検査の能力に基づいているだけなので、実際はどうなのか良くわかっておりません。転移の実態をできるだけ素早く知ることも重要ですが、なかなか患者はそのような機会に恵まれません。
現在、保険で使える画像検査で、もっとも転移の状態を詳細に捉えることができるのは、全身MRI検査(DWIBS)でしょう。ただし、これを実施している医療機関はさほど多くはありません。さらに高精度の検査ができるPSMA-PETの早期保険適用が望まれています。
転移性 去勢抵抗性前立腺がん:mCRPC
有転移のCRPCというのは、やはり手強いがんと言わざるを得ません。
薬剤の使用歴が多いほど、がんは悪性度が高いものに変化しやすいと言われており、そのようながんになってしまうと、通常の前立腺がんではあまり類を見ないほど急激に病状が悪化する場合があります。
転移量が多いにもかかわらず、PSAがあまり上昇していないような場合は、これに注意を払う必要があり、再度の生検を考慮する必要があるかも入れません。
現在、転移性CRPCに使える薬は、上表を見る限りそこそこありそうですが、ここに至るまでに使っている薬剤は除外する必要があるのと、交叉耐性により必ずしもすべての薬を効果的に使えるわけではないので、残る選択肢は見かけほど多くはありません。
・アパルタミド:
非転移性CRPCで承認された薬ですが、その後、転移性の前立腺がん全般に適応範囲が拡大されています。
・エンザルタミド(イクスタンジ)とアビラテロン(ザイティガ):
どちらも同程度の強力な新薬で、先に使った場合で効果があるのは(PSAが50%以下に低下するのは)、いずれも50%弱~60%弱ですが、これらの薬には交叉耐性があり、後で使う薬剤は治療成績が悪くなるので、基本的に、これらの薬の連続使用は好ましくないと言われています。
アビラテロンの後でエンザルタミドを用いる場合、効果ありの比率は、25~30% ですが、逆の場合は 10% 前後と言われています。
もし、これら両薬を引き続き使うのなら、これらの数字も頭に入れておいたほうが良いかもしれません。
・ドセタキセルとカバジタキセル:
いずれもタキサン系の抗がん剤で、カバジタキセルはドセタキセルの後でしか使うことはできません(健康保険の関係上)。
また、ドセタキセルの後には新規ホルモン療法剤よりカバジタキセルのほうが、全生存率、再発までの期間、共に優れているという比較試験の結果が報告されています。
薬剤の使用順序に決まりはなく、その都度、医師と相談せざるを得ないでしょう。
ただ、概ねの考え方としては、特に手強いがんの場合は、「ドセタキセル→カバジタキセル」という流れになりそうですが、通常の転移がんであれば、ドセタキセルの前に、新規ホルモン薬(1~2種類)を入れるぐらいの余裕はありそうです。
手強いがんというのは、こんな場合です。
・短期間でCRPCになった
・痛みなどの症状がある
・PSA倍加時間(ダブリングタイム)が短い
・内臓転移がある
・低PSAでも画像上病態の進行が見られる
・リスクの高い遺伝子変異がある
・神経内分泌がんに移行している
骨転移の対応も考えねばなりません。
骨転移の進行を抑える、骨修飾剤というものがありますが、よく使われているのはゾレドロン酸(ゾメタ)やデノスマブ(ランマーク)です。ただ、これらには、顎骨壊死というやっかいな副作用があるので、投与を受ける前には歯のメンテが欠かせません。
以前は骨転移の痛みに対しては、ストロンチウム89(メタストロン)が用いられていましたが、2019年より材料の供給ができなくなり、事実上消滅してしまいました。骨痛を抱えた患者にとっては強い味方でしたが、残念というほかありません。
ストロンチウムはβ線を放出する薬でしたが、これに変わって登場したのは、アルファー線を放出するラジウム223(ゾーフィゴ)で、こちらは骨転移部の治療だけではなく、CRPC患者の生存期間も延長するという薬です。
ただ、これを使うタイミングは少し難しく、転移量が多すぎてもいけないし、内臓転移があれば使えない。さらにアビラテロンと同時に使うとかえって病状を悪化させることが判明しており、新薬との併用も基本的に避ける傾向にあります。この治療に要する6ヵ月間、新薬による治療を休めるかどうかの判断をしなければなりませんが、その間PSAが上昇する可能性が高いので、これを受け入れられる状態にあるかどうかの判定が難しく、医師との十分な打ち合わせが必要となりそうです。
今後、期待できそうな新薬についても触れておきます。
前立腺がんに使われる抗がん剤と言えば、ドセタキセルやカバジタキセルなど、古いタイプの(殺細胞性:タキサン系)抗がん剤だけでしたが、昨今、新しいタイプの抗がん剤の治験も行われており、期待できそうな候補薬がいくつか登場してきています。
これらニュータイプの抗がん剤は、分子標的薬であったり、免疫チェックポイント阻害剤であったりするのですが、これらはすべて、適合する遺伝子変異と関連しており、これらの遺伝子変異を調べて適合薬を見つける治療法のことをゲノム医療と称しており、保険適用でこれを調べることが可能となっています。少し、早めに調べておいたほうが、今後の予定が立てやすいかもしれません。
期待の持てる新薬については、こちらをご覧ください。
・分子標的薬
・免疫チェックポイント阻害剤
骨転移について
骨転移があるのとないのとでは、治療法は大きく異なってしまします。しかし、初期の小さな転移の場合は、医師も判断に迷う場合があります。
前立腺がんの場合には、それを見分けるためにホルモン療法をしながらしばらく様子を見ることもあります。
本物の転移では、時間の経過共に影が薄くなることが多いのに対し、転移でない場合は影の形状に変化は現れません。
転移がんが判明すれば、医師からは薬物療法の提案があることが多いと思うのですが、
まだお若い方で(主観で結構です)健康、体力に自信があり、
リンパ節転移が骨盤内またはその近傍にとどまっているような状態であれば、
放射線治療により、4~5年ぐらい(中央値)はホルモン療法から解放され、
うまくいけば、そのまま治る可能性も望めないことはありません。
骨転移が数ヶ所(せいぜい3~4ヶ所)に留まっており、比較的安定した病状であるなら、
放射線治療によって、骨転移が一時消滅し、再発までの期間を延長できるかもしれません。
骨転移しやすいがんは、前立腺がん、乳がん、肺がんなどですが、前立腺がんは去勢抵抗性がんになり、病状が進行すると8~9割に骨転移が出現すると言われています。
骨転移は進行と共に痛みを伴い、骨損傷のリスクを増大させます。
脊髄を損傷すると、下半身が完全に麻痺し、排尿のコントロールも効かないまま、一生寝た切りに近い状態となる恐れもあり、
血液中に多量のカルシウムが溶け出す「高カルシウム血症」と呼ばれる状態になると、生命に危険が及ぶこともあります。
こうした骨転移症状の治療には、以下の様々な対応が考えられます。
骨痛のケア
前立腺がんの骨転移は、造骨型が多いと言われており、これは破骨型に比べて骨折等のリスクは少ないものの、痛みは強いと言われています。
疼痛ケアは緩和医療の一部ですが、本来の緩和医療とは、疼痛ケアに限らず、体と心の苦痛を和らげる全人的ケアのことで、がんと告げられた時をその始まりとして、がん治療のあらゆる過程で考慮されるべきものなのです。
(ここでは緩和医療の全体を詳しく述べる余裕はありません)
現実に痛みが生じている場合には、なにをさておき、疼痛の緩和を医師に訴えてみましょう。患者自身の痛みからの解放は、がん対策基本法でも重要項目として取り上げられている緩和医療の精神であり、訴えることになんら遠慮は要りません。
「WHO方式3段階除痛ラダー」に添った正しい緩和療法を受ければ、がん患者のほとんどは(90%近く)痛みから解放されることが可能ですが、
緩和ケア=終末期医療、モルヒネ(オピオイド)=最後の手段、という誤った認識が、一般社会のみならず医療者の間にもまだ残っているのではないでしょうか。
2006年の日本ペインクリニック学会の調査によれば、緩和療法とは何かを正しく把握している医師は半数にも満たなかったそうです。
G7(先進主要7カ国)におけるモルヒネ消費量は、日本が最下位、アメリカの1/20、カナダの1/12、ドイツの1/7 にしか過ぎません。
2008年から、厚労省のよって医師に対する緩和ケアの研修会が開催されるようになったので、医師の考え方もだいぶ変わってきたかもしれませんが、
緩和ケアの中心を担うがん薬物療法専門医の認定が始まったのは2005年からで、その数はまだまだ不足しています。
ただ現実的には、内分泌療法は元より、抗がん剤治療や骨転移に対する疼痛処置も、すべて泌尿器科医が行っている場合が多いようです。
緩和ケアについてのより詳しい解説は下記のリンク先をごらんください。
緩和ケア.net ・・・ 日本緩和医療学会
がんの痛みネット ・・・ がん疼痛・症状緩和に関する多施設共同臨床研究会
疼痛を考える全ての人へ ・・・ JPAP (Japan Partners Against Pain)
オピオイドが効きにくい痛みとして代表的なのは「骨転移痛」と「神経因性疼痛」です。
がん細胞が骨に転移し、分裂増殖を始めるのは、骨の中央部の海面質からですが、こうした初期の骨転移なら、オピオイドも効きやすいのですが、
外周の皮質骨(緻密質)が圧迫骨折を引き起こし、神経を損傷しているような進行型の骨転移では、その痛みも耐え難く、
運動機能も喪失し、オピオイドによる疼痛緩和も困難です。
こうした難治性の痛みに対して試みる価値があるのは、痛みを伝達する神経線維に注射を打つ神経ブロック療法、もしくは
皮下埋込型ポートを使って行うクモ膜下オピオイド投与です。
多量のオピオイドによる傾眠傾向のため、患者のQOLが大きく下がってしまっている場合では、クモ膜下オピオイド投与を行うと、
寝たきりだった患者が普通の生活ができるほど劇的に効くケースもあるとのこと。
ただし、疼痛緩和がうまく行ったとしても、それだけでは骨転移の進展を食い止めることはできませんので、
骨転移の緩和ケアは、以下の処置法と組み合わせて用いるのが一般的です。
骨病変の治療薬
骨には骨を壊す破骨細胞と骨を作る骨芽細胞という2種類の細胞があり、骨はそれらによって常に作り変えられています。
がん細胞は破骨細胞の力を借りて骨に転移します。
骨に転移したがん細胞には「溶骨型」と「造骨型」があるのですが、前立腺がんの場合は「造骨型」が多いと言われています。
骨転移そのものが直接生命に危険を及ぼすことはありませんが、痛み、喉の渇き、悪心、嘔吐、圧迫骨折、しびれ、麻痺、などの
さまざまな骨病変が現れます。
麻痺が生じて立てなくなったら、できれば24時間以内、遅くとも48時間以内に処置をする必要があるということは、覚えておいたほうが良いでしょう。
骨病変の治療薬としては、これまではビスフォスフォネート製剤が多く用いられてきました。
ビスフォスフォネートは元々は骨粗しょう症の治療薬として開発されたものですが、
骨転移、骨塩量の維持(ホルモン療法を継続すると骨塩量が低下しやすい)にも効果があり、
それらの効果が最も高いのが ゾレドロン酸(ゾメタ)です。
2012年4月から、我国でも、ビスフォスフォネートとは作用機序がまったく異なる新しい分子標的薬が、
骨転移患者に対して使えるようになりました。デノスマブ(ランマーク)がそれです。
ゾレドロン酸(ゾメタ)
ビスフォスフォネートは、骨密度の低下を防ぐことができ、骨破砕の危険を減らすと共に、骨痛を減少させます。
作用機序は完全には解明されていませんが、破骨細胞の活動を押さえ、
アポトーシス(細胞死)を引き起こすことにより、骨塩量の減少を食い止めると考えられています。
がん細胞は、破骨細胞を活性化させ、骨の破砕を引き起こす様々な要因を引き起こしますが、ビスフォスフォネートは、
破骨細胞の活動を抑えることによって、がん細胞の骨密度に及ぼす悪影響を小さくし、骨病変を緩和し、高カルシウム血症を改善させます。
骨転移や骨密度低下の治療薬として用いられているビスフォスフォネート製剤は、
以前は第2世代薬アレディア(パミドロン酸)が使われていましたが、
最近は第3世代薬ゾメタ(ゾレドロン酸)が使われるようになってきました。
ゾメタが特に優れているのは、アレディアと同等の効果を得るのに1/10未満の投与量で良いという点で、
従来数時間掛った点滴が15分程度で済むようになったことは、
この薬を利用する患者にとっては画期的なことと言えるでしょう。
ただ、長期に用いる場合には、腎障害と顎骨壊死(*)に注意が必要です。
* 顎骨壊死:「ビスフォスフォネート製剤による顎骨壊死」
デノスマブ(ランマーク)
多発性骨髄腫および固形がんの骨転移による骨病変の治療薬として、
2010年にFDA(米国食品医薬品局)の承認を受けたデノスマブ(ランマーク)が、
2012年春より、我国でも使用できるようになりました。
骨関連事象の発現を遅らせる効果は、ゾメタより優れているという報告もありますが、
我国ではまだ使用実績が少なく詳しいことは判っておりません。
重篤な副作用としては、顎骨壊死以外に、低カルシウム血症による危険性(死亡例)が報告されており、
厚生労働省からも注意喚起情報(2012/9/11)が出されました。
薬に副作用はつきものですから、必要以上に恐れることはないと思いますが、
注意事項をしっかり守ることが肝心ではないでしょうか。
”骨病変治療薬「ランマーク」投与患者での重篤な低カルシウム血症に関する注意喚起について”
http://www.mhlw.go.jp/stf/houdou/2r9852000002jjwe.html
■「ランマーク」【別添1】は、
多発性骨髄腫による骨病変及び骨転移を有する固形癌の骨病変の進展を抑える薬剤で、
破骨細胞の活性化を抑制することで、骨からカルシウムが溶け出すことを抑制する作用があり、
低カルシウム血症を起こすおそれがあることが知られている。
■7月10日に、「使用上の注意」を改訂し、重篤な低カルシウム血症が発現することについて注意喚起を行ってきたが、
その後、関連性の否定できない低カルシウム血症による死亡例が2例、厚生労働省に報告されている。
■患者の安全確保のため
1. 投与前及び投与後頻回に血清カルシウムを測定すること。
2. 充分量のカルシウム及びビタミンDを合わせて服用すること。
3. 重度の腎機能障害者では、低カルシウム血症を起こすおそれが高いため、
本剤を慎重に投与すること。
4. 低カルシウム血症が認められた場合には、速やかに適切な処置を行うことが重要。
■また、本剤投与中の患者にあっては、高カルシウム血症の場合を除き、医師の指示に従ってカルシウム及びビタミンDを
合わせて服用し、手足のふるえ、しびれ等の症状がある場合には直ちに医師に連絡することが重要である。
■このため、【別添2】のとおり、
「使用上の注意」の改訂を行うとともに、医薬関係者等に対して、
【別添3】により、
速やかに情報提供するよう、製造販売業者に対して指示した。
放射線による緩和(延命)照射
【緩和照射】
骨転移の個所がある程度限定されているような場合には、痛みの除去や軽減を目的として、放射線の外部照射が多く行われており、
ほとんどの場合に(約90%)除痛もしくは疼痛の緩和が見られます。
これまでは 3Gy x 10回が標準的でしたが、4Gy x 5回、5Gy x 4回 等というやり方も行われており、最近は、8Gyの単回照射も有効かつ安全であり、これまでの 3Gy x 10回 に劣らないという発表も出てきたので、いずれこの方向が主流になるのではないでしょうか。完治を狙う放射線療法に対し、痛みを緩和させるという意味で「緩和照射」と呼ばれています。
医療者の間では「姑息照射」とも呼ばれていますが、この用語はあまり好きになれません。
骨転移が背骨(頸椎・胸椎・腰椎)に生じた場合は、がん病巣の成長により脊髄が圧迫され、麻痺を生じることもありますが、
そうした場合はできるだけ早く(なるべく24時間以内、遅くとも48時間以内に)放射線治療を受けるべきです。
そのためには、放射線治療医が常駐し、随時緊急照射に応じてくれるような体制にあるかどうか、あらかじめ確認しておく必要がありあそうです。
麻痺が完全に出てからでは、放射線をあててもなかなか症状が改善しません。しびれ以前のなるべく早い段階での放射線治療が望まれます。
骨痛を取るための放射線の照射方法と放射線治療の副作用は、照射部位によって異なります。
やや低めの線量を広範囲に当てることが多いため、通常は高精度照射の必要はありません。
・激しい骨痛はオピオイド(医療用モルヒネ)が効かない場合も多い。
・手術やステロイドの大量投与と組み合わせる方法もあります。
・頸椎や胸椎などの主要支持部に対し、骨転移の危険性を回避するため、予防的放射線照射を
行うことがある。
【体内照射】(ラジウム223)
2007年よりベータ線を放出するストロンチウム89(メタストロン注)が、骨転移による疼痛緩和に広く用いられていましたが、2018年末より諸事情で入手が困難となりました。これを用いた治療法は、おそらく今後も難しいと思われます。アルファ線を放出するラジウム223(ゾーフィゴ)は、忍容性を保ちながら、生存期間の延長(中央値で約3ヵ月)をもたらすというデータが示されており、我国では2016年に保険適用となりました。 以降、転移性去勢抵抗性前立腺がん(mCRPC)の治療選択肢の一つとして良く用いられてきました。
アルファ線はベータ線に比べて放射線量が数倍大きく、一方、飛距離と崩壊時間は短くなります。ゆえに理論的には他の臓器に対する影響が小さいので、副作用も少ないと言われていますが、これも実際はかなり個人差があるようで、副作用がきつくて辛いとおっしゃる方もおられます。
Ra-223の排泄経路は主に糞便排泄であり、尿中排泄は極めて低いので、投与後数週間は尿よりも便の扱いに注意が必要かも知れません。
ゾーフィゴ単独ではPSAの上昇を抑えることは難しく、効果を測るにはALPの測定と画像検査が必須となります。
ドセタキセル後に使用する場合は、好中球の減少と血小板の減少に注意が必要です。6回投与できれば生存期間の延長が期待できるので、全身状態が悪くならない間に投与を開始することが望ましいと言われています。骨転移の量が多すぎたり、内蔵転移が出現しておれば、治療のタイミングとしては適切とは言えない(遅すぎる)ようです。
また、新規ホルモン療法薬アビラテロンとの併用は、逆に悪い結果を招くことも判明しており、ヨーロッパではすでに行われておらず、日本でも推奨されていないので、併用する薬には注意が必要です。
脊椎の圧迫骨折・麻痺
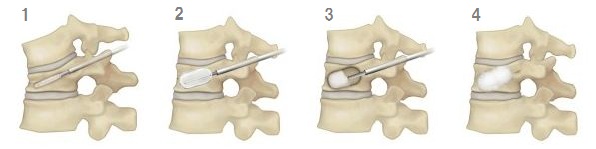
骨セメント療法
骨セメント療法という身体的負担の小さい骨痛緩和療法があります。
複数ある骨転移巣にも対応でき、CTで位置を確認しながら少し太めの注射針を刺し
1~2ccの骨セメント(ポリメチルメタクリレート)を注入し、半日安静に横たわるだけで、
ほぼ9割の人の骨痛が緩和され、2割の人の骨痛が完全に消えて、脆くなった骨の補強にもなる。
まれに、セメント材料が漏れ神経等を圧迫したり、血管に入って血栓を作り、肺塞栓を起こした例も報告されているので、
やはり経験豊富な医師が望ましいでしょう。
たとえ残された日々が限られていようと、日常生活動作が不自由なく行えるようになることは、患者ご本人にとっては大きな喜びに違いありません。
骨セメント療法を導入している医療機関をリストアップしておきますが、内容は未確認ですので、問合せに際しては十分ご注意ください。
・旭川厚生病院 ・岩手県立北上病院 ・岩手医科大学病院 ・福島県立医大病院(麻酔科)
・茨城県立中央病院 ・茨木県立中央病院 ・栃木県立がんセンター ・群馬大学病院
・聖路加国際病院 ・東京大学付属病院 ・聖マリアンナ医科大学病院 ・信州大学病院
・金沢大学病院 ・愛知県がんセンター ・滋賀医科大学病院 ・京都第一赤十字病院
・大阪市立大学病院 ・関西医大付属滝井病院 ・兵庫県立成人病センター ・岡山大学病院
・中国労災病院 ・広島大学病院 ・高知大学付属病院 ・久留米大学病院 ・福岡大学病院
(以上、特記なきものはすべて放射線科)
バルーン椎体形成術(BKP)
これは、一口で言えば骨セメント療法の進化版です。
骨粗鬆症等によりつぶれた背骨(圧迫骨折)に、背中側から細い針を差込み、骨の中でバル-ン(風船)を膨らませて、
つぶれた骨の形を元に戻した後、空いた空間に骨セメントを詰め、圧迫骨折の痛みをとる
バルーン椎体形成術(Balloon Kyphoplasty; BKP)という新治療法で、従来の骨セメント療法より確実性と安全性が高まっています。
2011年1月より健康保険が適応されましたが、急性期の圧迫骨折には適応がなく、
背骨の骨折から8週間以上経過してもなお痛みと変形が続いている場合に適用があるとのこと。
当初は骨粗鬆症などが原因の圧迫骨折だけが保健適用となっていましたが、1912年以降、がんによる脊椎転移にも適用が広がり、
前立腺がんでも保険診療による手術が可能となりました。
【施設認定基準】
1) 全身麻酔下及びエックス線透視下で経皮的後弯矯正術(Balloon Kyphoplasty)を実施
可能な施設。
2) 合併症発生時には、速やかに、全身麻酔下での脊椎除圧再建術や、血管修復術などの
緊急対応を行うことができる施設。
3) 本機器を使用した手術は、脊椎外科の専門知識を有し、本システム特定のトレーニングを
受けた医師のみが行うこと。
【使用する医療器機】
・KYPHON BKP システム
・KYHPON BKP 骨セメント
【バルーン椎体形成の手順】
1)骨折した椎体にバルーンのついた器具を入れる。
2)バルーンを膨らませ、椎体を元の形状に戻す。
3)バルーンを抜いた空間に骨セメントを充填。
4)手術(約1時間)中に骨セメントが硬化。
腫瘍脊椎骨全摘術
骨折が生じたり、脊髄圧迫による麻痺、あるいは他の治療法でどうしても痛みが取れないとき等は、整形外科的手法に頼らざるを得ません。
かつては患者の身体的負担が大きいため、なかなか踏み切れなかった治療法ですが、最近は生体になじみやすい人工部材が開発されると共に、
手術方法の洗練化も相まって、こうした手術も患者に身近なものとなってきました。
骨転移巣の腫瘍を切除撤去後、人工骨や人工関節、人工椎体、髄内釘(ずいないてい)等に置き換えるのが一般的な手術法で、
モルヒネや放射線で取りきれない体動時の痛みからも解放され、運動機能の回復も見込めることから、患者のQOLへの寄与も大きいと思われます。
特に前立腺がんの場合は、骨転移を生じても長く生きる患者が増えており、骨痛の除去に留まらず運動機能も含め、いかに不自由なく
高いQOLを保って生活を送れるかが関心事となってきており、こうした整形手術への期待も高まっていると言えましょう。
脊椎に転移したがんは、少しでも脊髄を損傷させると重大な麻痺や後遺症が残るため、脊椎の背中側から行うこれまでの手術法では
治療が難しいとされてきましが、脊椎の内側から細いワイヤーソー(糸鋸)を通し、転移巣を大胆かつ安全に切除し、
摘出跡周辺を抗がん剤で洗浄後、人工椎体もしくは自家骨を用いて脊椎を再建する”腫瘍脊椎骨全摘術”という手法があります。
ワイヤーソーを用いた脊椎骨全摘術が受けられる医療機関はいくつかありますが、先進医療として認定されているのは、2011年現在、金沢大学付属病院のみです。
・金沢大学付属病院 ・北海道大学病院 ・秋田大学附属病院 ・慶應大学病院
・濁協医科大学病院 (いずれも整形外科)
期待されるPSMA標的療法:早期承認を!
前立腺がんでは、毎年1万人以上の患者が亡くなっています。
転移を有する去勢抵抗性前立腺がんとなり、次の薬物療法の選択肢が見えなくなって来た時に、もし、大きな効果が期待できる新しい治療法が目の前に現れれば、どんなにありがたいことでしょう。
夢物語と言われるかもしれませんが、必ずしもそうではありません。現在、海外でそのような治療法がすでに生れつつあるのです。
その治療法は、第Ⅱ相臨床試験では目を見張るような治療効果が示されており、現在すでに第Ⅲ相臨床試験に突入し、そろそろその終盤にさしかかっています。
これまでの経緯から、第Ⅲ相臨床試験も好成績で終えることはほぼ間違いがないと目されており、早ければ2021年にも、米国等で承認されるのではないかという観測がされています。
この治療法は、放射性物質を扱う核医学分野では、大変注目されており、ヨーロッパ核医学会(EANM 2018)ではメインテーマの一つとして取り上げられたほどですが、日本では、まだ、泌尿器科系、放射線系の学会でも、多少話題に上る程度に留まっており、注視している専門医は少なからず居られるにも関わらず、全体的にはまだ盛り上がりに欠ける状態です。
この治療法とはどのようなものでしょうか。
前立腺がんの細胞膜に多く発現している分子を標的とする放射性化合物を静注し、前立腺がん細胞に集積させる治療法です。
前立腺がん細胞に送り届けられたアイソトープは、崩壊時に出す放射線(α線 or β線)で直接がん細胞を攻撃します。標的となるのは、前立腺がん細胞の被膜に多く発現するPSMA(前立腺膜特異抗原)という蛋白質の一種です。PSMA標的アイソトープ療法、あるいはもっと簡単にPSMA標的療法と言っても良いでしょう。
PSMAを標的とした小分子(リガンド)に、ベータ線を放出するルテチウム(117Lu)あるいはアルファ線を放出するアクチニウム(225Ac)をくっつけ、多発転移(骨に限らず、リンパ節や臓器転移であっても)を有する前立腺がん患者に注射すれば、多くの人で骨転移の影が薄くなり、PSA値が大幅に改善されるというものです。
177Lu(ルテチウム)-PSMA-617 の第Ⅱ相臨床試験の結果によると、患者50人中、32人でPSA値が50%以上低下し、その内22人では80%以上減少したという。
177Lu-PSMA617 theranostics を受けた前立腺転移がん患者8名の、治療前、治療後のPSMA-PET画像の比較資料を載せておきます。
PSMA PET before and after lutetium-177 PSMA617 theranostics in 8 patients with metastatic prostate cancer (IMAGE)
SOCIETY OF NUCLEAR MEDICINE AND MOLECULAR IMAGING
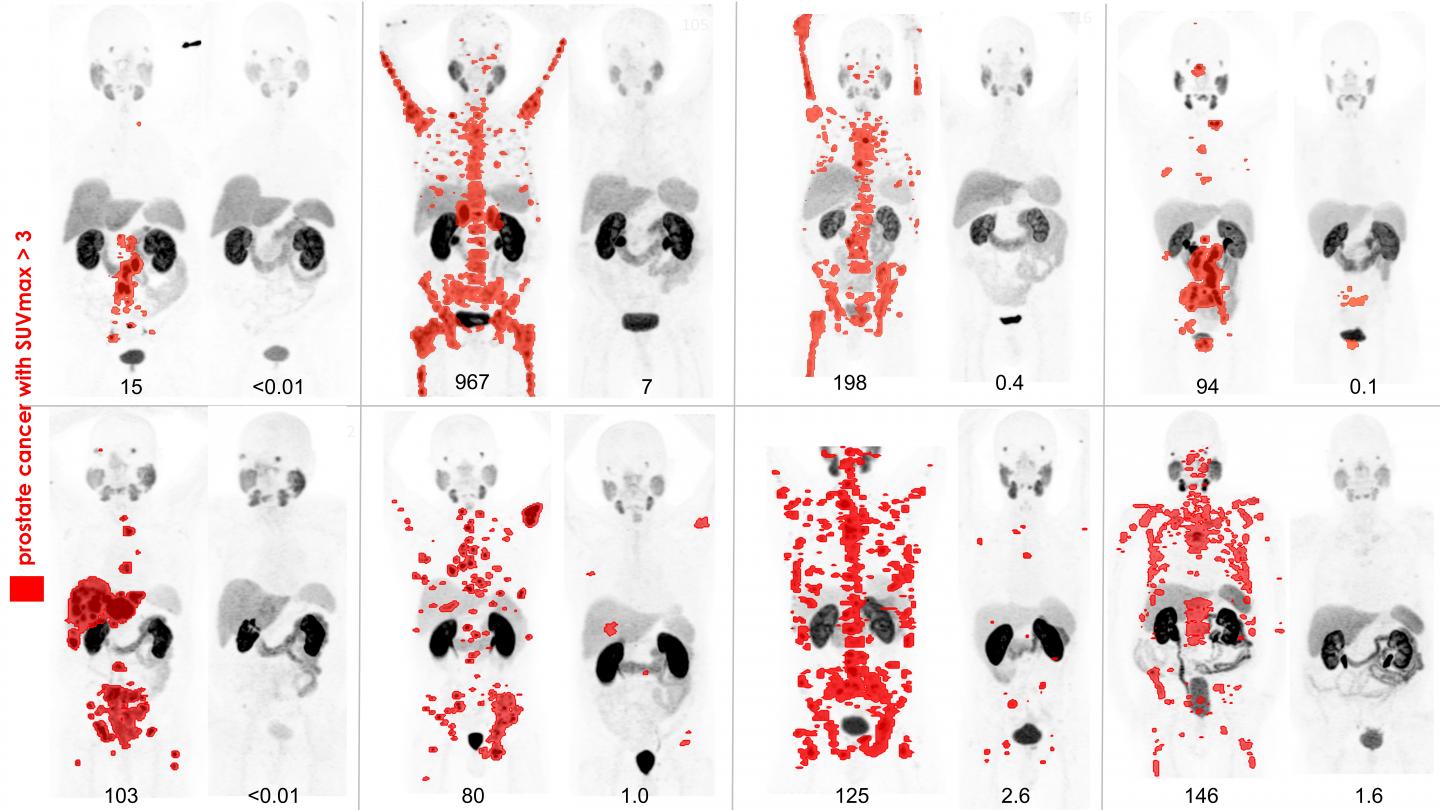
核医学分子イメージング学会において、2018年度画像大賞(SNMMI Image of the Year)となったのが上の画像です。
ホルモン療法薬や抗がん剤ではありえないほど驚異的な効果が示されています。去勢抵抗性となり薬物療法の選択肢も底をついているような患者であっても、
ほとんど転移の影が消えるような症例もあったようですが、現段階ではまだ過剰な期待は慎むべきかと。
生存期間(OS)をどれぐらい延ばせるかは、まだ明らかになっておりません。
副作用としてドライアイや唾液が出にくくなる症状があるようですが、これは、PSMAは前立腺がん細胞だけでなく、
唾液腺や涙腺にも少量含まれているからです。こうした症状による生活の質の低下は、まだ何とか工夫で乗り切れる程度のものであり、
次の治療法の見通しが立たないような患者さんにとっては、PSA値の低下と全身状態の改善のほうが、はるかに重要な問題だと思われます。
いずれにせよ「治癒」は望めないので「夢の治療法」とは言えませんが、再発・転移がんで治療法が無くなりつつある患者にとっては、正に福音といえる治療法ではないでしょうか。
ただ、全ての前立腺がん細胞にPSMAが発現しているとは限らないので、そのような前立腺がん細胞に対しては効き目がありません。しかし、
この治療法の興味深いところは、標識核種(アイソトープ)を変えることにより、診断にも用いることができるのです。
PET(Positron Emission Tomography、陽電子断層撮像法)に適合した核種(18F、68Gなど)を用いると、
PSMAを発現している前立腺がん細胞をかなり高精度で捉えることができます。
PSMA-PETで映った前立腺がん細胞は、治療用の核種に置き換えれば、そのまま治療の標的となるわけです。
つまりPSMA-PETを用いれば、事前にこの治療に適しているかどうかが分かるわけです。
Therapy(治療)と Diagnosis(診断)が表裏一体となったこのような形の治療法を、核医学分野では
セラノスティクス(Theranostics)と称しています。
PSMAを標的とした診断と治療は、表裏一体ではありますが、切り離せないというわけではありません。たとえば、術後、PSAが上昇し基準値を超えた場合は、
PSA再発と称していますが、これまでは、限局部の再発を疑い前立腺床を中心にその周辺に放射線を当てることが可能ですが、
限局部以外の再発が疑われるような場合には、がん細胞の位置を特定できないので、薬物療法しか手段がなかったわけです。
しかし、PSMA-PETによって、がんの位置を特定できれば、その部分を狙って放射線を当てるなど、新たな治療手段が見つかる可能性が出てくるわけです。
もし、今後、PSMA-PETの認可が先行し、PSMAを標的とする治療が、心ならずも遅れるような経過を辿ったとしても、
患者にとっての価値は十分あると思っています。
しかし、いずれにせよ現時点では、国内でこのような治療を受けることはできません。
海外では、PSMA-PETをやっている国は、すでにたくさんあり、いずれ近いうちにPSMA標的療法が正式に認可されようとしています。
さらに突っ込んで言えば、ドイツ、オーストラリア、マレーシア等数カ国では、実際にPSMA療法による患者の治療が先行して行われており、
すでに日本からも10名を越える患者さんが、その治療を受けに渡航されているという現実があるのです。
この治療法は、海外では早ければ2020年にも承認される可能性があるという状況になっていますが、
我国では、PSMA標的療法の臨床試験はまだ始まる気配もありません。
日本ではアイソトープ(放射性物質)の規制が厳しいこともあり、アイソトープを用いた検査や治療の認可はとかく遅れる傾向が強いようです。
PSMA-PET(PET/CT)を用いた臨床試験は、2019年から京大、阪大等で始まっています(受付はすでに終了)。
日本では、これまで薬の承認が諸外国に比べて大きく遅れるドラッグ・ラグ問題がしばしば騒がれていましたが、近年、ようやく海外に対しても、概ね1~2年以内に追随、承認できる体制になってきているようですが、アイソトープは一般の医薬品とは趣が異なり、抵抗感が強く、このまま手をこまねいていては、日本での承認が大幅に遅れることが懸念されます。
腺友倶楽部としても、「出来るだけ早期に、患者がこの治療法の恩恵を受けられるよう、便宜を諮ってほしい」という要望を、専門医等の関係団体とも協力し、所轄官庁に訴えることができないか、その方向に向け動き始めているところです。